Boylov zakon (Boyle–Mariotte) - zakon idealnih plinov: definicija in primer
Boylov zakon – jasna razlaga za idealne pline: definicija, enačba PV=k, korak‑za‑korakom rešitev primera in zgodovina odkritja Boyla in Mariotta.
Boylov zakon (imenovan tudi Mariottov zakon ali Boylov–Mariottov zakon) je osnovni fizikalni zakon o idealnih plinih, ki opisuje razmerje med tlakom in prostornino pri nespremenjeni temperaturi in množini plina.
Definicija
Za določeno količino idealnega plina pri določeni temperaturi sta P (tlak) in V (prostornina) obratno sorazmerna.
Z drugimi besedami: za konstanto maso plina pri konstantni temperaturi se prostornina spreminja obratno sorazmerno s tlakom. Če se prostornina zmanjša, se tlak sorazmerno poveča in obratno.
Matematična oblika
Boylov zakon lahko zapišemo kot:
P ∝ 1 V {\displaystyle P\propto {\frac {1}{V}}}
ali kot konstanta:
P V = k {\displaystyle PV=k}
Kjer je P tlak plina, V prostornina in k konstanta za dano maso in temperaturo. Če primerjamo dve stanji iste količine plina pri isti temperaturi, velja:
P 1 V 1 = k {\displaystyle P_{1}V_{1}=k}
P 2 V 2 = k {\displaystyle P_{2}V_{2}=k}
Ker je k enaka v obeh stanjih, dobimo klasično obliko:
P 1 V 1 = P 2 V 2 {\displaystyle P_{1}V_{1}=P_{2}V_{2}}
Primer izračuna
Primer: začetni tlak plina je 3 atm in prostornina 5 L. Če tlak zmanjšamo na 2 atm, kolikšna bo nova prostornina?
P 1 V 1 = P 2 V 2 {\displaystyle P_{1}V_{1}=P_{2}V_{2}}
Iz tega izrazimo V2:
V 2 = P 1 V 1 P 2 {\displaystyle V_{2}={\frac {P_{1}V_{1}}{P_{2}}}}
V 2 = 3 ∗ 5 2 {\displaystyle V_{2}={\frac {3*5}{2}}}
V 2 = 15 2 {\displaystyle V_{2}={\frac {15}{2}}}
V 2 = 7,5 {\displaystyle V_{2}=7,5}
∴ Prostornina bo 7,5 L.
Pojasnilo na molekularni ravni
Boylov zakon lahko pojasnimo z enostavnim modelom delcev: pri enaki temperaturi delci ohranjajo povprečno kinetično energijo. Če zmanjšamo prostornino vsebnika, se povprečna pot delcev skrajša, a se poveča število trkov delcev s stenami na enoto časa. Več trkov pomeni večji pritisk na stene.
Povezava z idealnim plinskim zakonom
Boylov zakon je posebni primer idealnega plinskega zakona PV = nRT, kjer sta število molov n in temperatura T konstantna. V tem primeru je nRT konstanta, zato PV = konst.
Omejitve in veljavnost
- Boylov zakon velja za idealne pline ali za realne pline približno pri nizkih tlaki in zmernih temperaturah, kjer odstopanja zaradi medmolekulskih sil in volumna delcev niso pomembna.
- Pri visokih tlakih in nizkih temperaturah realni plini odstopajo; takrat je treba uporabiti bolj napredne modele (npr. van der Waalsov zakon).
- Paziti je treba na vrsto tlaka: v eksperimentih je treba uporabiti absolutni tlak. Če delamo z merami gauge tlaka, je treba pri preračunu upoštevati atmosferski tlak.
Uporabe
Boylov zakon se uporablja pri razlagi in izračunih v številnih praktičnih primerih, npr. pri delovanju zdravilnih injekcij, delovanju pnevmatskih cilindrov, pri merjenju v špricalkah in brizgah, pri delu z injektorji in pri osnovnem razumevanju dihanja (pri enakih temperaturah med stanjema).
Zgodovina
Zakon je prvi demonstriral Robert Boyle leta 1662; neodvisno pa ga je leta 1679 opisal tudi Edme Mariotte, zato se v literaturi zakon pogosto imenuje Boyle–Mariotte.
Opomba: v enačbah je k (> 0) konstanta, ki je odvisna od mase plina in temperature. Za praktične izračune pazite na enote tlaka in prostornine (npr. atm in L, Pa in m3) ter po potrebi pretvorite v medsebojno združljive enote.
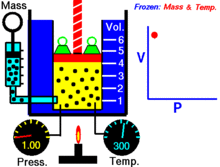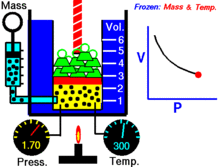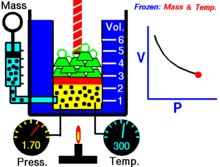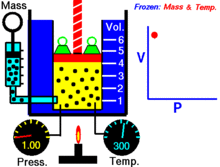
Animacija, ki prikazuje povezavo med tlakom in prostornino.Količina in temperatura plina sta konstantni.
Vprašanja in odgovori
V: Kaj je Boylov zakon?
O: Boylov zakon (imenovan tudi Mariottov zakon in Boylov-Mariottov zakon) je zakon o idealnih plinih, ki pravi, da sta za določeno količino idealnega plina pri konstantni temperaturi tlak (P) in prostornina (V) obratno sorazmerna.
V: Kako lahko matematično izrazimo Boylov zakon?
O: Boylov zakon lahko matematično izrazimo kot P ∝ 1/V ali PV = k, kjer je P tlak plina, V prostornina plina, k pa konstanta.
V: Kdo je odkril ta zakon?
O: Zakon je leta 1662 odkril Robert Boyle, nato pa ga je leta 1679 neodvisno odkril Edme Mariotte.
V: Kaj pomeni, ko rečemo, da sta P in V obratno sorazmerna?
O: To pomeni, da se s povečevanjem enega sorazmerno zmanjšuje drugi - če torej zmanjšamo prostornino posode, v kateri je določena količina plina pri določenem tlaku, se bo zaradi povečanih trkov med delci, ki so posledica manjšega prostora, tlak povečal.
V: Kako uporabimo Boylov zakon za izračun sprememb tlaka ali prostornine?
O: Boylov zakon lahko uporabimo za izračun sprememb tlaka ali prostornine s pomočjo dveh enačb - P1V1=k in P2V2=k - kjer k ostane konstanten, medtem ko se P1/V1 ali P2/V2 spremeni, odvisno od tega, kaj želimo izračunati.
V: Ali lahko ta zakon uporabimo tudi za prave pline?
O: Ne - velja samo za idealne pline, saj med njimi ni medmolekularnih sil.
Iskati








