Karben – definicija, struktura, singlet/triplet in reaktivnost
Karben: jasna definicija, struktura ter singlet/triplet razlikovanje; reaktivnost, tipi reakcij in primeri (vključno z Grubbsovim katalizatorjem).
Karben (pogosto zapisan kot R2C: ali R-(C:)-R') je nevtralna ogljikova vrsta, pri kateri ima ogljikov atom samo dve σ-vezi in dve dodatni valenčni elektroni, ki ne tvorita vezi. Ker ima ogljik v takšni konfiguraciji le 6 valentnih elektronov (namesto običajnih 8), je karben običajno zelo reaktiven in kratkotrajen. Molekula z ogljikovim atomom z dvema vezi in dvema prostima elektronoma obnaša se bodisi kot elektrofilska bodisi kot nukleofilska jedra, odvisno od elektronske strukture in substituentov.
Elektronska struktura in hibridizacija
Elektronska razporeditev pri karbenih je ključna za njihovo obnašanje. Ogljik običajno kaže sp2 hibridizacijo z enim praznim p-orbitalom in enim hibridnim orbitalom, ki lahko vsebuje en par elektronov ali en neparen elektron, odvisno od stanja. Zaradi tega sta možni dve osnovni elektronski konfiguraciji: singlet in triplet.
Singlet in triplet karbeni
Singletni karben: v singletnem stanju sta dva nebirična elektrona spodobljena kot osamljeni par v isti hibridni orbitali (običajno sp2), medtem ko je navpičen p-orbital prazen. Tak karben pogosto deluje kot močan elektrofiličen reagent (ker ima prazno p-orbital, ki lahko sprejme elektronski par). Singletni karbeni so običajno bolj reaktivni v adicijskih reakcijah in lahko sodelujejo v heterolitskih procesih.
Tripletni karben: v tripletnem stanju sta elektrona neparna in zasedeta dve različni orbitali (eden v sp2-hibridnem, drugi v p-orbitalu), z enakima spinoma — to daje karbenu biradikalen značaj. Tripletni karbeni so pogosto manj elektrofilski in bolj sebični pri radikalnih reakcijah, npr. lahko vodijo do radikalnih adicij ali abstrakcij vodika.
Energijska razlika med singletom in tripletom je odvisna od substituentov pri ogljiku: substituenti, ki zmorejo delovati kot π-donatorji (npr. sosednji heteroatomi ali aromatski sistemi) ali katerih resonančna stabilizacija zmanjša energijo praznega p-orbitala, bodo navadno favorizirali singlet. Substituenti, ki stabilizirajo radikalno naravo (npr. alkilne skupine preko hiperkoordinacije), pa lahko favorizirajo triplet. Primer: :CH2 (metilen) ima triplet kot osnovno stanje, medtem ko je :CCl2 (diklorokarben) singletni v osnovnem stanju.
Reaktivnost in tipične reakcije
Karbeni sodelujejo v različnih organskih reakcijah, med najpomembnejšimi so:
- Ciklopropanacija (adiciija na dvojne vezi) – karbeni se dodajo na alkenične vezi in tvorijo ciklopropanske obroče; to je osnova mnogih sintetičnih postopkov za pripravo ciklopropanskih derivatov.
- Vstavljanje v C–H in X–H vezi – karbeni lahko insertirajo v vezi C–H, O–H ali N–H in s tem tvorijo nove vezi C–C, C–O ali C–N.
- Radikalne reakcije in abstrakcije – tripletni karbeni pogosto povzročijo abstrakcijo vodika iz molekule in tvorbo radikala.
- Cheletropne reakcije – karbeni lahko sodelujejo v cheletropnih cikličnih adicijah (na primer s konjugiranimi dieni).
- Koordinacija na kovine in metalo-karbeni – karbeni tvorijo stabilne komplekse s kovinami (npr. Grubbsov katalizator), ki so ključni v reakcijah metateze olefinov in drugih kataliznih procesih.
Nastanek karbenov
Karbeni se generirajo z več kemijskimi postopki, med katerimi so najpogostejši:
- Termična ali fotokemijska razgradnja diazo spojin (R2C=N2 → R2C: + N2) — zelo pogost in učinkovit vir karbenov.
- α-Eliminacija halogenalkanov (npr. priprava diklorokarbena iz kloroformana z močno bazo).
- Metalno-posredovane poti — metalni kompleksi lahko generirajo karbene (metalo-karbeni) ali prenašajo karbeno enoto na organske substrat.
- Termoliza ali fotoliza primernih prekurzorjev — nekatere spojine ob segrevanju ali sevanju sprožijo nastanek karbenov.
Stabilizacija in vzdržnost
Večina prostih karbenov je zelo kratkotrajna zaradi visoke reaktivnosti. Vendar lahko določene strukture karbenov izkazujejo veliko stabilnost (persistentni ali "bottleable" karbeni):
- N-heterociklični karbeni (NHC) so močno stabilizirani z deljenjem elektronov iz sosednjih dušikov in s steričnim oviranjem, zato so izolabilni in široko uporabljeni kot ligandi v katalizi.
- Sterično zaščitene karbeni (z velikimi substituenti) so manj dovzetni za bimolekulske reaktivnosti in so lahko vzdržni dlje časa.
- Resonančno stabilizirani karbeni (npr. z arilnimi substituenti) imajo razpršeno elektronovo gostoto in so zato stabilnejši kot enostavni alifatski karbeni.
Primer praktične uporabe stabiliziranega karbena je Grubbsov katalizator, kjer je karben kot del kovinsko-organovskega kompleksa odgovoren za olefinsko metatezo — to je močno orodje v sintetični organski kemiji.
Detekcija in karakterizacija
Kratkotrajne karbene vrste se pogosto zaznavajo s hitrimi spektroskopskimi tehnikami (npr. časovno-resolved UV/Vis spektroskopija, EPR za tripletne vrste) ali pa se proučujejo posredno preko produktov reakcij. Stabilni karbeni pa je mogoče karakterizirati z NMR, IR, rentgensko kristalografijo itd.
Za zaključek: karbeni so ključne, a pogosto kratkotrajne reaktivne vrste ogljika z dvema nedelnima elektronoma. Njihovo obnašanje (elektrofilno, nukleofilno ali radikalno) in stabilnost močno odvisita od substitucije in okolja; v nadzorovanih pogojih pa so izjemno uporabni v sintezi in katalizi.
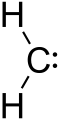
Karben
Vprašanja in odgovori
V: Kaj je karben?
O: Karben je molekula z ogljikovim atomom, ki ima dve vezi, in dvema drugima elektronoma, ki ne tvorita vezi.
V: Zakaj je karben reaktiven?
O: Ogljik v karbenu ima okoli sebe le 6 elektronov, zato je precej reaktiven.
V: Kakšna je splošna formula karbena?
O: Splošno formulo karbena lahko zapišemo kot R-(C:)-R'.
V: Kateri sta dve vrsti karbenov?
O: Dve vrsti karbena sta singlet in triplet.
V: Kakšna je razlika med singletnim in tripletnim karbenom?
O: V singletnem karbenu sta dva elektrona, ki ne tvorita vezi, kot osamljeni par in ostaneta v isti orbitali. V tripletnem karbenu sta elektrona v različnih orbitalah in imata enak spin.
V: Katere reakcije lahko potekajo s karbeni?
O: Karbeni lahko potekajo v številnih reakcijah. Lahko so elektrofili in nukleofili, radi pa izvajajo adicijske reakcije na dvojne vezi. Najdemo jih tudi v cheletropnih reakcijah.
V: Ali so karbeni stabilni?
O: Večina karbenov je zelo nestabilna, vendar lahko nekateri obstajajo dolgo časa. Primer je Grubbsov katalizator, ki ga je razvil Robert Grubbs.
Iskati