Molekula: definicija, struktura, vezi in molekulske formule
Molekula: jasna definicija, razlaga strukture, vrste vezi in razlage molekulskih formul s primeri (C6H12O6) — razumljivo za študij in vsakdan.
Molekula je najmanjša enota kemične snovi, ki ohranja njene kemijske lastnosti. Če bi molekulo razdelili na manjše dele (npr. ločili vezi med atomi), bi nastali posamezni atomi ali drugi delci in snov s kemijskega vidika ne bi več obnašala enako kot prvotna molekula.
Sestava in vezi
Molekule so sestavljene iz atomov, ki so povezani v določeno obliko ali obliko. Povezave med atomi so lahko kovalentne (delitev elektronov), ionske (elektrostatično privlačenje nasprotno nabitih ionov) ali z manjšo stopnjo kovalentnosti/ionskosti. Pomembno je razumeti, da izraz "molekula" običajno pomeni skupino atomov, ki so covalentno povezani; ionske spojine, kot je NaCl, se pogosto obravnavajo kot ionske mreže ali formulačne enote, ne kot posamezne molekule.
Atomi imajo določene elektronske konfiguracije in zato tudi nagnjenost k tvorbi določene številke vezi, kar opisuje valenca. Na primer, atomi kisika običajno tvorijo dve vezi, atomi ogljika običajno štiri, atomi dušika pa običajno tri. Vendar se te vrednosti lahko spreminjajo zaradi formalnih nabojev, koordinacijskih števil in redkih oksidacijskih stanj (npr. peroksidi, kompleksi prehodnih kovin).
Geometrija in struktura
Razporeditev atomov v molekuli določa njeno molekulsko geometrijo, ki vpliva na lastnosti in reaktivnost. Geometrijo pogosto napovemo z uporabo teorije odbijanja parov valenčnih elektronov (VSEPR) ali s kvantno-mehanskimi pristopi (molekulske orbitale). Nekaj pomembnih konceptov:
- Lewisove formule: prikazujejo pare elektronov, vezi in lone paire.
- VSEPR: napove prostorsko ureditev atomov glede na odbijanje elektronov.
- Molekulske orbitale: kvantno-mehanski pogled na vezanje (vezne in antivezne orbitale, deljenje elektronov preko orbital).
- Resonanca in izoerji: nekatere molekule, npr. benzen, imajo delokalizirane elektrone in več dopustnih struktur (resonančne strukture).
Polarnost, vezi in medmolekulske sile
Molekule so lahko nepolarne ali polarne, odvisno od porazdelitve elektronske gostote in geometrije. Polarne vezi in molekule vodijo do dipol-dipol interakcij, prav tako pa zelo pomembno vlogo igrajo vodikove vezi (npr. med molekulami vode). Šibkejše so disperzijske (Londonove) sile, ki delujejo med vsemi molekulami, a so ključne za lastnosti nepolarnih snovi. Medmolekulske sile vplivajo na vrelišče, tališče, topnost in druge fizikalne lastnosti snovi.
Stanja snovi in gibanje molekul
V kinetični teoriji se izraz molekula pogosto uporablja za vse plinske delce ne glede na njihovo sestavo. Tako se za namene modeliranja plinov atomi žlahtnih plinov običajno štejejo kot enoatomne molekule (glej tudi monatomne pline). V različnih agregatnih stanjih se obnašanje molekul razlikuje:
- V plinih, kot je zrak, se molekule gibljejo prosto in imajo velike prostorske razdalje med seboj.
- V tekočinah, kot je voda, so molekule bližje in med njimi delujejo medmolekulske sile, zato se lahko premikajo glede na druge, a so še vedno povezane.
- V trdnih snoveh, kot je sladkor, so molekule običajno urejene in lahko le vibrirajo okoli svojih ravnovesnih položajev.
- V četrtem stanju snovi, imenovanem plazma, so atomi pogosto ionizirani in elektroni ločeni od jeder, zato se stabilne molekule na splošno težje tvorijo ali hitro razpadejo.
Molekulske formule in masa
Z molekulsko formulo zapišemo števila atomov vsakega elementa v eni molekuli. Molekulska formula glukoze je na primer C6H12O6, kar pomeni, da ena molekula vsebuje šest atomov ogljika, dvanajst atomov vodika in šest atomov kisika. Poleg molekulske formule obstaja še empirična formula (najenostavnejše razmerje med atomi) in strukturna formula, ki pokaže, kako so atomi povezani.
Iz molekulske formule lahko izračunamo molekulsko maso (molarno maso) s seštevanjem atomskih mas vseh atomov v molekuli. Ta veličina je ključna pri stehiometrijskih izračunih v kemiji.
Primeri molekul
- O2 (kisik) – diatomska molekula, pomembna za dihanje organizmov.
- H2O (voda) – polarna molekula s pomembnimi vodikovimi vezmi.
- CO2 (ogljikov dioksid) – linearna molekula, ključna za fotosintezo in dihanje.
- CH4 (metan) – tetraedrična molekula, najpreprostejši ogljikov spoj.
- C6H6 (benzen) – aromatska molekula z delokalizirano elektronsko strukturo.
Analiza in opazovanje molekul
Molekule proučujemo z različnimi eksperimentalnimi metodami: infrardeča (IR) spektroskopija razkriva vibracije vezi, jedrska magnetna resonanca (NMR) daje informacije o elektronskem okolju atomov, masna spektrometrija daje maso in sestavo, rentgenska difrakcija pa podrobno prostorsko ureditev atomov v kristalih.
Pomen molekul
Molekule so osnova kemije in biokemije: od enostavnih plinov do zapletenih biomolekul (beljakovine, DNK, ogljikovi hidrati) določajo lastnosti snovi, kemijske reakcije in življenje kot ga poznamo. Razumevanje njihove strukture, vezi in interakcij je ključno za razvoj novih zdravil, materialov in za razlago naravnih procesov.
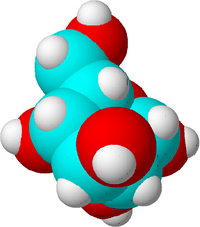
To je molekula sladkorja. Ogljikovi atomi so modri, kisikovi rdeči, vodikovi pa beli, da se pokaže razlika. V resnici atomi nimajo barve.
Lepljenje
Za obstoj molekule morajo biti atomi zlepljeni skupaj. To se zgodi, ko si dva atoma delita elektrone. Namesto okoli enega atoma elektron zdaj kroži okoli dveh. To se imenuje kovalentna vez. Včasih se deli več elektronov. Več elektronov kot si jih delimo, močnejša je vez in močneje se atomi držijo skupaj.
Vezi se lahko tudi prekinejo. Ker je za nastanek večine vezi potrebna energija, se pri njihovem razpadu tudi odda energija. Preden pa se večina vezi pretrga, je treba molekulo segreti. Nato se atomi začnejo premikati, in ko se premaknejo preveč, se vez pretrga. Molekule, ki za pretrganje potrebujejo manj energije, kot je oddajo ob pretrganju, imenujemo goriva. Na primer, sveča samo sedi in se nič ne zgodi. Če pa jo prižgete z vžigalico, bo dolgo gorela. Vžigalica prinese energijo za prekinitev prvih vezi, ki sprostijo dovolj energije za prekinitev vezi pod njimi, dokler sveča ne zgori.
Obstajajo tudi ionske vezi.
Vprašanja in odgovori
V: Kaj je molekula?
O: Molekula je najmanjša količina kemične snovi, ki lahko obstaja. Sestavljena je iz atomov, ki so zlepljeni skupaj v določeni obliki ali obliki.
V: Koliko vezi imajo atomi kisika, ogljika in dušika?
O: Kisikovi atomi imajo vedno dve vezi z drugimi atomi, ogljikovi atomi imajo vedno štiri vezi z drugimi atomi, dušikovi atomi pa imajo vedno tri vezi z drugimi atomi.
V: Kaj o molekulah pravi kinetična teorija plinov?
O: V skladu s kinetično teorijo plinov se izraz molekula pogosto uporablja za vse plinske delce ne glede na njihovo sestavo. To pomeni, da se atomi žlahtnih plinov štejejo za molekule, saj so dejansko enoatomne molekule.
V: Kako se molekule obnašajo v različnih stanjih?
O: V plinih, kot je zrak, molekule lebdijo naokoli. V tekočinah, kot je voda, so molekule zlepljene skupaj, vendar se še vedno lahko premikajo. V trdnih snoveh, kot je sladkor, lahko molekule samo vibrirajo. V plazmi (četrto stanje snovi) so atomi ionizirani in ne morejo tvoriti molekul.
V: Kaj je molekulska formula?
O: Z molekulsko formulo zapišemo število vseh atomov v molekuli. Na primer C6H12O6 označuje eno molekulo glukoze, ki je sestavljena iz šestih atomov ogljika, dvanajstih atomov vodika in šestih atomov kisika.
Iskati