Izolobalna analogija v organokovinski kemiji: definicija in primeri
Izolobalna analogija v organokovinski kemiji — jasna definicija, primeri in analiza HOMO/LUMO za napoved vezav, reaktivnosti ter praktične uporabe.
Izolobalno načelo (znano tudi kot izolobalna analogija) je koncept za razumevanje in napovedovanje veznih lastnosti organokovinskih spojin. V organokovinski kemiji se nanaša na primerjavo strukture organskih ligandov in anorganskih molekulskih fragmentov, ki se lahko vežejo na kovinske centre. Roald Hoffmann je molekulske fragmente opisal kot izolobalne, "če so število, simetrijske lastnosti, približna energija in oblika mejnih orbital ter število elektronov v njih podobni — ne enaki, ampak podobni".
Osnovna merila izolobalnosti
Da sta si dva fragmenta izolobalna, mora biti izpolnjenih več pogojev:
- Enako število »mejnih« orbital (frontier orbitals), ki lahko sodelujejo v vezavi.
- Podobna simetrija teh orbital glede na osnove simetrije fragmenta.
- Primerljiva oblika in energija orbital (HOMO in LUMO), kar omogoča podobne načine prekrivanja in interakcije z drugimi fragmenti ali ligandi.
- Podoben valenčni elektronski račun ali ustrezne formalne oksidacijske/elektronske razlike, ki jih je ob upoštevanju mogoče izenačiti.
Kako se uporablja v praksi
Izolobalna analogija poenostavi razmišljanje o vezavi in reaktivnosti z uporabo dobro poznanih organskih fragmentov kot modelov za anorganske ali kovinske fragmente. Če imata dva fragmenta podobne mejne orbitale, HOMO in LUMO, lahko na podlagi lastnosti enega predvidimo vedene drugega. Tako lahko:
- napovemo možne geometrije in vezave novih organokovinskih kompleksov,
- predvidimo reaktivne poti in možnosti nastanka sabstitucijskih ali adicijskih produktov,
- načrtujemo sinteze z uporabo analogij med organsko kemijo in kemijo prehodnih kovin.
Primeri
V literaturi so pogosti primeri prikazani kot pari, kjer organski fragmenti (npr. radikali ali karbeni) stojijo nasproti kovinskim fragmentom z enakim številom mejnih orbital in podobno simetrijo. Nekateri pogosto citirani primeri vključujejo:
- Metilni radikal (•CH3) in nekateri kovinski fragmetni radikali (npr. trivalentni fragmenti prehodnih kovin ob prisotnosti karbonilnih ligandov). Ti fragmenti imajo po en mejni orbital, ki lahko deluje kot enotna vezovalna enota.
- Karbeni fragmenti (:CH2) in dvovalentni kovinski fragmenti, ki imajo dve mejni orbitali in lahko tvorijo dvojne ali dvo-centrirane vezi.
- Borovinasti fragmenti (npr. BH2) in nekateri karbinski ali kovinski fragmenti — primeri iz bora in ogljika pogosto služijo kot smernice za sintezo borovinastih kompleksov.
Pomembno je poudariti, da so navedeni pari predstavitveni — natančna identiteta kovinskega fragmenta (npr. kateri ligand ali oksidacijsko stanje) vpliva na energijo in obliko orbital, zato se izolobalnost ocenjuje fragment-po-fragment in pogosto ob vključitvi računskih metod ali spektroskopije.
Primeri uporabe: od teorije k sintezi
Izolobalna analogija se pogosto uporablja pri načrtovanju novih kompleksov tako, da se iz znanih organskih molekul »prevede« pričakovano vezavo na kovinski center. Pogosti scenariji so:
- konstrukcija večjedrnih (multimetalnih) jeder z uporabo izolobalnih fragmentov,
- predvidevanje stabilnosti klastrskih spojin in njihovih geometrijskih izomerov,
- prilagajanje ligacijskih modelov iz organskih molekul za uporabo v katalizi prehodnih kovin.
Meje in omejitve
Hoffmann je ob prejemu Nobelove nagrade za kemijo (1981) opozoril, da je izolobalna analogija uporaben, a poenostavljen model. Njene omejitve vključujejo:
- razlike v energiji orbital med analognimi fragmenti, ki lahko povzročijo drugačno reaktivnost,
- sterične učinke in vpliv ligandskega okolja, ki niso zajeti le z analizo mejnih orbital,
- razlike v oksidacijskih stanjih in multipletnih stanjih kovinskih centrov, ki lahko bistveno spremenijo kemijsko vedenje,
- kompleksne večcentrične vezi in delokalizacije, ki jih preprosta izolobalna slika ne pojasni v polnosti.
Zaključek
Izolobalna analogija je močno konceptualno orodje, ki povezuje znanja iz organske in anorganske/organokovinske kemije. Omogoča kemikom, da z uporabo znanih lastnosti enega tipa fragmenta razumejo ali predvidijo vedenje drugega. Vendar je treba rezultate vedno preveriti z dodatnimi računi, eksperimentalnimi podatki ali spektroskopijo, saj so podrobnosti (energije orbital, ligandski vplivi, oksidacijska stanja) pogosto kritične za pravilno napovedovanje.
Hoffmannovo delo in širša uporaba izolobalne analogije sta tako prispevala k boljšemu razumevanju in načrtovanju kompleksnih organokovinskih struktur, obenem pa opominjata, da gre za model — uporaben, a z omejitvami.
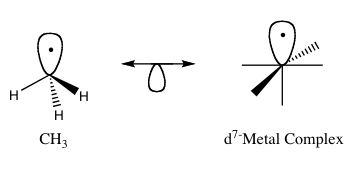
Slika 1: Osnovni primer analogije z izoliranim materialom.
Vprašanja in odgovori
V: Kaj je izolobalno načelo?
O: Izolobalno načelo (znano tudi kot izolobalna analogija) je način za napovedovanje lastnosti vezi organokovinskih spojin. Povezuje strukturo organskih ligandov, ki se lahko vežejo na anorganske molekulske fragmente, s primerjavo njihove najvišje zasedene molekulske orbitale (HOMO) in najnižje nezasedene molekulske orbitale (LUMO).
V: Kdo je predlagal izolobalno načelo?
O: Roald Hoffmann je predlagal izolobalno načelo.
V: Kako se nanaša na izoelektronske spojine?
O: Izolobalne spojine so analogne izoelektronskim spojinam, ki imajo enako število valenčnih elektronov in enako strukturo.
V: Kaj je Hoffmann prejel za svoje delo na tem konceptu?
O: Hoffmann je za svoje delo na področju analogije z izolobalnimi spojinami leta 1981 prejel Nobelovo nagrado za kemijo, ki si jo je delil s Keničijem Fukuijem.
V: Kako je Hoffmann opisal molekularne fragmente?
O: Hoffmann je opisal molekulske fragmente kot izolirane, "če so število, simetrijske lastnosti, približna energija in oblika mejnih orbital ter število elektronov v njih podobni - ne enaki, ampak podobni".
V: Kako lahko ta model uporabimo za napovedovanje vezi in reaktivnosti?
O: Vezavo in reaktivnost manj znanih kosov lahko napovemo na podlagi vezave in reaktivnosti bolj znanih kosov, če imajo podobne mejne orbitale.
V: Ali ta model vedno deluje pravilno?
O: Ne, v nekaterih primerih je neuspešen.
Iskati