Ligand: molekula, vezava, funkcija in afiniteta v biokemiji
Ligandi: kako molekule vežejo receptorje, spreminjajo funkcijo beljakovin, vrste vezav in merjenje afinitete — vodnik za biokemijo in farmakologijo.
Ligand je biokemična snov. Njena naloga je, da se veže na biološko molekulo in jo prisili, da opravlja določeno funkcijo. Vezava liganda spremeni obliko receptorskega proteina. To spremeni obnašanje beljakovine.
V ožjem smislu je to molekula, ki sproži signal in se veže na mesto na ciljnem proteinu.
Vezava poteka z medmolekulskimi silami, kot so ionske vezi, vodikove vezi in van der Waalsove sile. Priključitev (asociacija) je običajno reverzibilna (disociacija).
Ligandi vključujejo substrate, inhibitorje, aktivatorje in nevrotransmiterje. Nagnjenost ali moč vezave se imenuje afiniteta.
Kaj je ligand — enostavna razlaga
Ligand je molekula ali ion, ki se specifično veže na drugo molekulo (pogosto protein) in spremeni njeno funkcijo ali aktivnost. Ligandi so lahko zelo majhni (npr. kovinski ioni), organski molekuli (npr. hormoni, nevrotransmiterji, zdravila) ali večje molekule (npr. proteini, nukleinske kisline).
Vrste ligandov in primeri
- Substrati: molekule, ki jih encim pretvori v produkt.
- Agonisti in aktivatorji: ligandi, ki povečajo aktivnost receptorja ali encima.
- Inhibitorji (kompetitivni, nekompetitivni, irreversible): zmanjšajo ali blokirajo aktivnost tarče.
- Neurotransmiterji in hormoni: prenašajo signale med celicami.
- Ko-faktorji in koencimi: mali molekuli, nujni za delovanje encimov (npr. vitamini, metalni ioni).
- Metalni ioni: lahko služijo kot ligandi (npr. Zn2+, Ca2+) v beljakovinskih aktivnih mestih.
Mesto vezave in mehanizmi
Ligandi se vežejo na specifična mesta vezave na beljakovinah. Obstajata dve osnovni teoriji, ki opisujeta, kako pride do ujemanja med ligandoma in proteinom:
- Lock-and-key (ključavnica in ključ) — mesto vezave ima že v predhodnem stanju obliko, ki ustreza ligandu.
- Induced fit — vezava liganda povzroči konformacijske spremembe v proteinu, tako da se mesto prilagodi ligandu.
Vezava poteka zaradi kombinacije šibkih interakcij: vodikovih vezi, ionskih interakcij, hidrofobnih stikov in van der Waalsovih sil. V nekaterih primerih pride do kovalentne (irreverzibilne) vezave, kar je pomembno pri nekaterih zdravilih (npr. aspirin acetilira encime).
Afiniteta, specifičnost in kinetika
Afiniteta opisuje, kako močno se ligand veže na tarčo. Pogosto se kvantificira z disociacijskimi konstanto Kd (Kd = koff / kon). Nižja vrednost Kd pomeni večjo afiniteto. Afiniteta je odvisna od kemijskih interakcij in termina prostornine vezavnega mesta.
Kinetika vključuje hitrosti asociacije (kon) in disociacije (koff). Razmerje teh hitrosti določa Kd. Hitro nastajanje in počasen odcepitek (nizki koff) pogosto pomeni dolgotrajno vezavo.
Specifičnost pomeni, kako selektiven je ligand za določen cilj v primerjavi z drugimi molekulami. Ligand z visoko afiniteto ni nujno zelo specifičen — zato pri zdravilih iščemo optimalno kombinacijo afinitete in specifičnosti, da zmanjšamo neželene učinke.
Allosterija in kooperativnost
Some proteini imajo več vezavnih mest in lahko delujejo alosterično: vezava liganda na eno mesto spremeni afiniteto drugih mest. Kooperativnost (npr. pri hemoglobinu) pomeni, da vezava enega liganda poveča ali zmanjša verjetnost vezave naslednjega. Ta pojav se pogosto opisuje s Hillovim koeficientom.
Merjenje vezave
Različne metode omogočajo merjenje afinitete in kinetike vezave:
- ITC (kalorimetrija izotermične titracije) — meri toploto vezave in omogoča izračun Kd, ΔH in stehiometrije.
- SPR (surface plasmon resonance) — spremlja kinetiko asociacije in disociacije v realnem času.
- Fluorescenčne metode (fluorescenčna anisotropija, kvenching) — uporabne za majhne ligande.
- Radioligandno vezanje — visoka občutljivost pri določenih sistemih.
- Strukturne metode: rentgenska kristalografija, NMR, cryo-EM — pokažejo natančno lego liganda v mestu vezave.
Faktorski vplivi in biološke razmere
Afiniteta in vezava sta odvisni od zunanjih pogojev: pH, ionne jakosti, temperature in prisotnosti drugih molekul ali ko-faktorjev. Tudi post-translacijske modifikacije beljakovin (fosforilacija, metilacija itd.) lahko močno vplivajo na vezavno mesto in afiniteto.
Pomembnost v biologiji in medicini
Ligandi so ključni za prenos signalov v organizmih, regulacijo encimskih poti in delovanje živčnega sistema. V farmakologiji je cilj razvoja zdravil iskati ligande, ki so specifični in imajo primerno afiniteto do tarčnih receptorjev ali encimov. Poznavanje mehanizmov vezave omogoča racionalno oblikovanje zdravil (structure-based drug design) in razvoj biomarkerjev ter biosenzorjev.
Zaključek
Ligandi so osnovni gradniki molekularne komunikacije v celici. Njihova vezava na tarčne molekule, dinamika in afiniteta določajo, ali bo signal aktiviran, utišan ali modificiran — zato so ključni tako za razumevanje biologije kot za razvoj terapij.
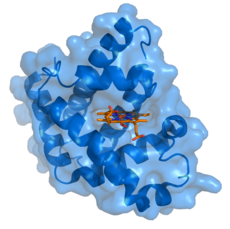
Mioglobin (modro) z vezanim ligandom hemom (oranžno).
Sorodne strani
- Prenos signalov
- Citokini
- Agonist
- Antagonist receptorja
Vprašanja in odgovori
V: Kaj je vez?
O: Ligand je biokemična snov, ki se veže na biološko molekulo, da bi ta opravljala določeno funkcijo.
V: Kako vezava liganda vpliva na receptorski protein?
O: Vezava liganda spremeni obliko receptorskega proteina, kar spremeni njegovo obnašanje.
V: Kako pride do vezave liganda?
O: Ligand se veže z medmolekulskimi silami, kot so ionske in vodikove vezi ter van der Waalsove sile.
V: Ali je vezava liganda reverzibilna?
O: Da, vezava ligandov je običajno reverzibilna in se lahko disociira.
V: Kateri so primeri ligandov?
O: Ligandi vključujejo substrate, inhibitorje, aktivatorje in nevrotransmiterje.
V: Kako imenujemo tendenco ali moč vezave?
O: Nagnjenost ali moč vezave se imenuje afiniteta.
V: Kakšna je posebna funkcija liganda v povezavi s ciljnimi beljakovinami?
O: V ožjem smislu je ligand molekula, ki sproži signal in se veže na določeno mesto na ciljnem proteinu.
Iskati