Izotopi vodika: protium (1H), devterij (2H) in tritij (3H) — lastnosti
Izotopi vodika: spoznajte protij (1H), devterij (2H) in radioaktivni tritij (3H) — njihove lastnosti, stabilnost, uporabe in pomen v znanosti.
Vodik ima tri glavne izotope: protrij (1H), devterij (2H) in tritij (3H). Ti izotopi nastajajo naravno v naravi. Protij in devterij sta stabilna. Tritium je radioaktiven in ima razpolovno dobo približno 12 let. Znanstveniki so ustvarili še štiri druge izotope vodika (4H to 7H), vendar so ti izotopi zelo nestabilni in ne obstajajo v naravi.
Glavni izotopi vodika so edinstveni, saj so edini, ki imajo ime. Ta imena se uporabljajo še danes. Devterij in tritij včasih dobita lastna simbola, D in T. Vendar pa Mednarodni zvezi za čisto in uporabno kemijo ta imena niso preveč všeč, čeprav se pogosto uporabljajo. Obstajajo še drugi izotopi, ki so imeli svoja imena, ko so znanstveniki preučevali radioaktivnost. Vendar se njihova imena danes ne uporabljajo več.
Osnovne fizikalne in atomske lastnosti
Protium (v izvirnem besedilu kot protrij, običajno pravilen izraz je protium) ima en proton in nima nevtronov; njegova atomska masa je približno 1,007825 u. Devterij (2H ali D) ima en proton in en nevtron, atomska masa približno 2,014102 u. Tritij (3H ali T) vsebuje en proton in dva nevtrona, atomska masa približno 3,016049 u.
Razlika v masi med isotopi povzroči opazne izotopne učinke v kemijskih reakcijah in fizikalnih lastnostih (npr. v vezi z vodikom). Devterij povzroči večjo vezno energijo in nekoliko drugačne termodinamične lastnosti kot protium.
Naravna pojavnost in pridobivanje
Naravna abundanca: protium predstavlja večino vodika v naravi (~99,985 %), devterij je redek (~0,0156 % ali približno 156 ppm v zemeljskem vodu), tritij pa je v naravi ekstremno redek — nastaja predvsem zaradi kozmičnega sevanja v zgornjih plasteh ozračja in v sledovih ga najdemo v vodi ter v biosferi.
Umetna proizvodnja: tritij se industrijsko proizvaja v jedrskih reaktorjih in v pospeševalnikih (npr. z interakcijami nevtronov z litijem ali borom ter z reakcijami v težkovodnih reaktorjih). Devterij se loči iz običajne vode z metodami, kot so frakcijska destilacija, izmenjava vodika in elektroliza — končni produkt je težka voda (D2O).
Radioaktivnost tritija in varnost
Tritij je beta-oddajnik: razpada v helij-3 (3He) z razpolovno dobo približno 12,32 let. Emitirani beta delci so nizkoenergijski (končna energija približno 18,6 keV), zato imajo omejeno prodirno moč (ne prebijajo kože), vendar lahko predstavljajo zdravljenjski riziko, če se trojev vnešeno v telo (voda, prah ali plin).
Varnostne smernice poudarjajo preprečevanje vdihavanja ali zaužitja tritija in omejevanje notranje izpostavljenosti. Ker se tritij kemično vključi v vodne molekule (T2O, HTO), se v organizmih obnaša podobno kot voda in se porazdeli po telesnih tekočinah.
Uporabe izotopov vodika
- Devterij (D): uporaben kot stabilen izotop v NMR spektroskopiji (deuterirani topili), kot tracer v biokemiji in okoljsko-znanstvenih študijah, ter kot komponenta težke vode (D2O), ki se uporablja kot moderator v težkovodnih jedrskih reaktorjih (npr. CANDU).
- Tritij (T): uporablja se kot radioaktivni tracer v znanstvenih raziskavah, v svetlečih številkah in izhodnih znakah (radiosvetleči viri), v nuklearni fuziji kot gorivo (reakcija D–T je najverjetnejša za pridobivanje energije iz fuzije), in v vojaških aplikacijah (npr. dvig energije v termonuklearnih napravah). Zaradi radioaktivnosti je njegova uporaba regulirana.
- Protium: osnovni in najpogostejši izotop vodika; nima posebnih industrijskih aplikacij kot označen izotop, vendar je osnova za vse običajne kemijske uporabe vodika.
Redki izotopi 4H–7H
Izotopi 4H do 7H so bili opaženi v jedrskih poskusih z ubrizgavanjem jedrskih delcev v tarče. Ti izotopi so izjemno nestabilni (z življenjsko dobo pogosto zelo kratko, tipično v območju 10−22 do 10−21 s) in razpadajo z izpustom nevtronov ali s spontanimi cepitvami — ne obstajajo v naravi v stabilni obliki in nimajo praktičnih aplikacij zunaj osnovnih jedrskih raziskav.
Notacija in konvencije
Za označevanje se pogosto uporabljata obe notaciji: številski indeks kot v 1H, 2H, 3H ter simboli D in T za devterij oziroma tritij. Mednarodna pravila (IUPAC) priporočajo uporabo številske notacije (2H, 3H), vendar sta D in T široko sprejeta in v vsakdanji rabi zelo pogosta.
Kratek povzetek
Izotopi vodika — protium (1H), devterij (2H) in tritij (3H) — se razlikujejo predvsem po številu nevtronov. Devterij je stabilen in pomemben za znanost in industrijo (težka voda, NMR, sledilci), tritij pa je radioaktiven z razpolovno dobo ~12,32 let in je ključnega pomena za fuzijsko raziskovanje in kot radioaktivni tracer. Ostali izotopi (4H–7H) so zelo kratkotrajni in nastanejo le v jedrskih poskusih.
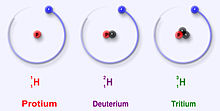
Trije najbolj stabilni izotopi vodika
Protium (vodik-1)
Protij je najpogostejši izotop vodika. Predstavlja več kot 99,98 % vsega vodika v vesolju. Imenuje se protium, ker ima njegovo jedro samo en proton. Atomska masa protija je 1,00782504(7) u. Simbol za protij je 1H.Proton protona v protumu pri opazovanju ni nikoli razpadel, zato znanstveniki menijo, da je proton stabilen izotop. Nove teorije fizike delcev predvidevajo, da proton lahko razpade, vendar je ta razpad zelo počasen. Razpolovna doba protonov naj bi bila 1036 let. Če je razpad protona resničen, potem so vsa druga jedra, ki naj bi bila stabilna, pravzaprav stabilna le opazovalno, tj. videti so, kot da so stabilna. Nedavni poskusi so pokazali, da bi bila razpolovna doba razpadanja protonov, če do njega res pride, 6,6 × 1033 let.
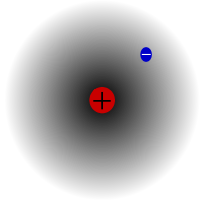
Protium, najpogostejši izotop vodika. Njegova posebnost je, da je edini izotop, ki nima nevtrona.
Devterij (vodik-2)
Devterij, 2H ali včasih D, je drugi stabilni izotop vodika. Izotop ima en proton in en nevtron. Predstavlja približno 0,0026-0,0184 % vseh atomov vodika na Zemlji. Devterija je manj v vodikovem plinu na Zemlji in več v morski vodi (0,015 % ali 150 ppm). Devterij ni radioaktiven in ne škoduje živim bitjem. Devterij lahko tvori tudi molekule vode. Voda, ki ima namesto protija devterij, se imenuje težka voda.
Tritium (vodik-3)
Tritium (3H) je najstabilnejši radioizotop vodika. Med vsemi radioaktivnimi izotopi vodika je tritij najmanj radioaktiven. V svojem jedru ima proton in dva nevtrona. Tritij razpade z razpadom beta minus in se spremeni v helij-3. Njegova razpolovna doba je 12,32 leta.Tritij nastaja naravno z interakcijo med plini v zgornjih plasteh ozračja in kozmičnimi žarki. Nastaja tudi med preizkušanjem jedrskega orožja. Tritij in devterij se uporabljata pri jedrski fuziji D-T v zvezdah, pri kateri se sprošča veliko energije.
Vprašanja in odgovori
V: Koliko je glavnih izotopov vodika?
O: Obstajajo trije glavni izotopi vodika: protij, devterij in tritij.
V: Ali sta protij in devterij stabilna izotopa?
O: Da, protij in devterij sta stabilna izotopa.
V: Kakšen je razpolovni čas tritija?
O: Tritium je radioaktiven in ima razpolovni čas približno 12 let.
V: Koliko drugih izotopov vodika so ustvarili znanstveniki?
O: Znanstveniki so ustvarili štiri druge izotope vodika: 4H do 7H.
V: Ali ti štirje dodatni izotopi vodika obstajajo v naravi?
O: Ne, ti izotopi so zelo nestabilni in ne obstajajo v naravi.
V: Zakaj so glavni izotopi vodika edinstveni?
O: Glavni izotopi vodika so edinstveni, ker so edini izotopi, ki imajo ime.
V: Ali imata devterij in tritij svoje simbole?
O: Da, deuterij in tritij imata včasih svoje simbole: Vendar Mednarodna zveza za čisto in uporabno kemijo teh imen ne mara preveč, čeprav se pogosto uporabljata.
Iskati