Osamljeni par elektronov: definicija, lastnosti in vloga v kemiji
Osamljeni par elektronov - jasna definicija, ključne lastnosti in vloga v kemiji za razumevanje oblik molekul, nukleofilnosti in reakcijskih mehanizmov
Osamljeni par je skupina dveh elektronov, ki se ne uporabljata v vezeh med atomi. Običajno se nahajata v zunanji elektronski lupini, torej v valenčni lupini, in skupaj z elektroni, ki sodelujejo v vezi, določata skupno število valenčnih elektronov atoma. Ti elektroni se pogosto imenujejo tudi nevezni ali "nesparjeni" elektroni (čeprav izraz "nesparjeni" v nekaterih kontekstih pomeni en sam elektron — tu gre za par dveh). Energetsko se nevezna orbitalska raven običajno nahaja med energijo veznih in antiveznih orbitalov, zato imajo ti elektroni pomembno vlogo pri kemijski reaktivnosti.
Kako jih prikažemo in preštejemo
V Lewisovih strukturah se osamljeni pari običajno prikazujejo kot pike okoli simbolov elementov. Za pravilno določitev števila osamljenih parov v molekuli sledimo preprostim korakom:
- Izračunamo skupno število valenčnih elektronov vseh atomov.
- Narišemo osnovno ogrodje vezi in odštejemo elektrone, ki so porabljeni za vezi.
- Preostale elektrone razporedimo kot osamljene pare tako, da zadovoljijo oktet (ali duet pri vodiku) tam, kjer je to mogoče.
- Če je potrebno, uporabimo večkratne vezi ali formalne naboje, da izpolnimo občutke stabilnosti.
Vpliv na geometrijo molekul (VSEPR)
Osamljeni pari zavzamejo prostor okoli jedra atoma in običajno zavzamejo več prostora kot vezni elektronski pari. To vpliva na obliko molekule. Po teoriji odboja elektronov v valenčni lupini (VSEPR) si nevezni pari prizadevajo biti čim bolj oddaljeni eden od drugega in od veznih parov, kar povzroča spremembe bondnih kotov:
- Primer: H2O ima dva osamljena para na kisiku in je zato upognjena (kot približno 104,5°), ne pa linearna.
- NH3 ima en osamljeni par na dušiku in zato trigonalno-piramidalno obliko (kot približno 107°), namesto tetraedričnega 109,5° pri CH4, ki nima osamljenih parov.
Kemijske lastnosti in reaktivnost
Osamljeni pari so ključni pri številnih kemijskih pojavih:
- Nukleofilnost in basičnost: Atomi ali skupine z osamljenimi pari lahko delujejo kot Nukleofili oziroma kot Lewisove baze, saj lahko podarijo par elektronov in napadejo elektronsko revne centre, torej elektrofile. Primeri so O v alkoholu ali aminu, S v tiolih ali lone pair na halogenih v substitutionskih reakcijah.
- Vodikove vezi: Osamljeni pari na O, N ali F sodelujejo kot sprejemniki v vodikovih vezeh, kar pomembno vpliva na topnost, vrelišče in strukturo snovi (npr. voda, alkoholi, amini).
- Reaktivnost v organski kemiji: Lone pari na kisikovih ali dušikovih atomih pogosto sodelujejo v nukleofilnih napadih na karbonilne ogljikove atome ali se vključujejo v adicije/elimacije.
- Spektroskopske lastnosti: Nevezne elektrone lahko sodelujejo v n→π* prehodih (v UV/vidnem delu spektra) ali vplivajo na položaj IR absorpcij (npr. pri lone-pair sprejemnikih v vezi z vodikom).
Orbitalna narava in hibridizacija
Osamljeni pari zasedajo orbite, ki so lahko hibridne (npr. sp3 v H2O ali NH3) ali tudi skoraj čiste p-orbitale (v nekaterih primerih konjugiranih sistemov). Narava orbitale vpliva na razporeditev prostora in energijo lone para. V določenih molekulah so lone pari del delokaliziranih sistemov (rezonance), kjer se elektronka gostota razporedi čez več atomov, kar zmanjšuje lokalizirano reaktivnost.
Rezonanca, formalni naboj in poseben primer: inertni par
V sistemih z rezonanco (npr. acetatni ion, amidi) se osamljeni pari lahko delokalizirajo in prispevajo k stabilnosti preko konjugacije z dvema vezema. To spremeni njihovo razpoložljivost kot nukleofil: delokalizirani pari so manj reaktivni kot močno lokalizirani. Pri težjih elementih p-bloka (npr. Pb, Sn) se pojavlja t. i. inertni par — s-orbitalni elektroni, ki so manj reaktivni in ne sodelujejo pri vezanju, kar vpliva na oksidacijska stanja teh elementov.
Primeri in praktični pomen
- H2O: kisik ima dva osamljena para → molekula je ukrivljena; lone pari omogočajo vodo kot dober vodikov vezni sprejemnik in nukleofil.
- NH3: dušik ima en osamljeni par → molekula je trigonalno-piramidalna in deluje kot baza (npr. v reakcijah z H+ daje amonijev ion).
- CO (ogljikov monoksid): ima lone pare na kisiku in delno na ogljiku; eden od lone parov na ogljiku omogoča vez s kovinskimi centri (ligandno vedenje).
- O-atom v karbonilnih skupinah: ima nevezne pare, ki lahko sodelujejo v koordinaciji s kovinskimi centri ali v intramolekularnih interakcijah.
Zaključek
Osamljeni pari so temeljni element kemijske strukture in reaktivnosti. Vplivajo na geometrijo molekul, določajo lastnosti kot so basičnost, nukleofilnost in sposobnost tvorbe vodikovih vezi ter sodelujejo v rezonanci in spektroskopskih prehodih. Razumevanje njihove narave (lokaliziranost, energetika, hibridizacija) je ključnega pomena za napovedovanje vedenja molekul v kemijskih reakcijah in pri oblikovanju funkcionalnih snovi.
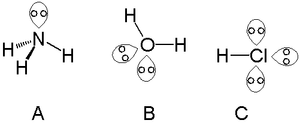
osamljeni pari v amoniaku (A), vodi (B) in klorovodikovi kislini (C)
Iskati