Baterija (kemijska celica): definicija, vrste in uporaba
Baterija (kemijska celica): definicija, vrste in uporaba — izvedite, kako delujejo primarne in sekundarne baterije, tipične uporabe, prednosti ter nasvete za varno izbiro.
Kemijska celica pretvarja kemijsko energijo v električno. Večina baterij so kemične celice: v njih poteka kemična reakcija, ki povzroči električni tok. Baterija je lahko sestavljena iz ene same celice ali iz več celic, povezanih zaporedno ali vzporedno, odvisno od potrebne napetosti in zmogljivosti.
Kako deluje baterija
V osnovi ima vsaka baterija dve elektrodi — anodo (negativna elektroda) in katodo (pozitivna elektroda) — ter elektrolit, ki omogoča gibanje ionov. Med praznjenjem se pri anodi odvija oksidacija (izguba elektronov), pri katodi pa redukcija (sprejem elektronov). Elektroni tečejo po zunanjem vezju od anode do katode in ustvarjajo električni tok. Med polnjenjem (pri polnilnih baterijah) se smer reakcije obrne.
Vrste baterij
- Primarne/baterije za enkratno uporabo (nepolnilne): ko se kemikalije porabijo, baterija ne proizvaja več električne energije. Pogoste so alkalne in cink-ogljik baterije — pogosto jih imenujemo tudi "uporabi in vrzi".
- Sekundarne/akumulatorske baterije (polnilne): energijo je mogoče obnoviti z dovajanjem električnega toka v obratni smeri. Te baterije je leta 1859 izumil francoski znanstvenik Gaston Plante. Med pogostejše vrste sodijo svinčevo-kislinske (lead-acid), nikelj-kadmijeve (NiCd), nikelj-metalni hidridi (NiMH) in litij-ionske (Li-ion).
- Tokovne baterije (flow battery): shranjevanje energije temelji na tekočih elektrolitih, ki so ločeni v rezervoarjih — koristne za večje sisteme za shranjevanje energije.
- Gorivne celice: kemično proizvajajo elektriko s kontinuiranim dovajanjem goriva (npr. vodika). Te se po principu razlikujejo od običajnih baterij, ker gorivo ni zaprto v celici, ampak se dovaja skozi čas.
Najpogostejše kemije in značilnosti
- Alkalne (1,5 V): poceni, široko razširjene v daljinskih upravljalnikih, igračah in svetilkah.
- Gumbne celice (npr. srebrove oksidne, litijeve): zelo majhne, za ure, kalkulatorje, slušne aparate.
- Svinčevo-kislinske (lead-acid): uporabljene v avtomobilskih startnih baterijah in za rezervo napajanja; robustne in poceni, vendar nizka energijska gostota.
- NiMH (1,2 V): nadomeščajo NiCd v številnih napravah; imajo višjo kapaciteto in manjšo toksičnost od NiCd.
- Litij-ionske (≈3,6–3,7 V na celico): visoka energijska gostota, uporaba v prenosnih napravah, električnih vozilih in sistemih za shranjevanje energije; občutljive na temperaturo in zahtevajo zaščitne krmilnike zaradi tveganja termičnega bega.
Glavni tehnični pojmi
- Napetost (V): električni potencial med elektrodama; odvisna od kemije celice.
- Kapaciteta (Ah ali mAh): količina naboja, ki ga baterija lahko shrani; pove, koliko časa lahko napaja napravo pri določeni porabi.
- Energijska gostota (Wh/kg): koliko energije je shranjene glede na maso — pomembno pri prenosnih napravah in vozilih.
- Notranja upornost: vpliva na izgube in padce napetosti pri visokih tokovih; višja upornost pomeni večje izgube in segrevanje.
- Življenjska doba (število ciklov): število polnjenj/praznjenj, ki jih baterija prenese, preden kapaciteta pade pod uporabno raven.
Uporaba in primeri
Baterije so različnih oblik in velikosti, od zelo majhnih, ki se uporabljajo v igračah in fotoaparatih, do tistih, ki se uporabljajo v avtomobilih, in celo večjih. Podmornice potrebujejo zelo velike baterije. Velike baterijske sisteme uporabljajo tudi za:
- shranjevanje obnovljive energije (sonce, veter),
- rezervno napajanje za bolnišnice in telekomunikacije,
- električna vozila (pogonske baterije),
- prenosne elektronske naprave (telefoni, prenosniki).
Varnost, skladiščenje in recikliranje
Baterije lahko predstavljajo varnostno tveganje: nepravilno polnjenje, mehanske poškodbe ali izpostavljenost visokim temperaturam lahko povzročijo puščanje elektrolita, požar ali eksplozijo, zlasti pri nekaterih litij-ionskih tehnologijah, kjer obstaja tveganje termičnega bega. Zato je pomembno uporabljati prave polnilnike, upoštevati navodila proizvajalca in ne izpostavljati baterij ekstremnim pogojem.
Porabljene baterije vsebujejo težke kovine in druge nevarne snovi, zato jih ne smemo zavreči v navadne odpadke. Recikliranje je ključno — mnoge vrste baterij je mogoče reciklirati, s čimer se zmanjšuje okoljski vpliv in omogoča vračanje dragocenih materialov v proizvodnjo novih celic.
Nasveti za dolgo življenjsko dobo
- Shranjujte baterije na hladnem in suhem mestu; visoke temperature pospešujejo staranje.
- Pri litij-ionskih baterijah se izogibajte popolnim praznjenjem in daljšemu hranjenju pri 100 % napolnjenosti — za daljše shranjevanje sta optimalni približno 40–60 % stanje napolnjenosti.
- Uporabljajte kvalitetne polnilnike in sledite navodilom za polnjenje za določeno kemijo.
- Pravilno reciklirajte iztrošene baterije v zbirnih centrih ali pri prodajalcih, ki nudijo vračilo.
Razumevanje osnov delovanja, glavnih vrst in parametrov pomaga izbrati primerno baterijo za namen ter skrbno in varno ravnati z njo, s čimer podaljšamo njeno uporabnost in zmanjšamo vpliv na okolje.
Vrste kemičnih celic
- Enostavna celica
- Suha celica
- Mokra celica
- Gorivna celica
- Sončna celica
- Električna celica
Elektrokemijske celice
Izjemno pomemben razred oksidacijskih in redukcijskih reakcij se uporablja za pridobivanje uporabne električne energije v baterijah. Enostavno elektrokemijsko celico lahko naredimo iz kovin bakra in cinka z raztopinami njunih sulfatov. Med reakcijo se lahko elektroni prenašajo s cinka na baker po električno prevodni poti kot uporaben električni tok.
Elektrokemijsko celico lahko ustvarimo tako, da kovinske elektrode postavimo v elektrolit, kjer kemijska reakcija uporablja ali ustvarja električni tok. Elektrokemijske celice, ki ustvarjajo električni tok, se imenujejo voltaične ali galvanske celice, običajne baterije pa so sestavljene iz ene ali več takih celic. V drugih elektrokemijskih celicah se za sprožitev kemijske reakcije, ki ne bi potekala spontano, uporablja zunanji električni tok. Takšne celice se imenujejo elektrolitske celice.
Voltaične celice
Elektrokemijsko celico, ki povzroča zunanji pretok električnega toka, je mogoče ustvariti z uporabo dveh različnih kovin, saj se kovine razlikujejo po tem, da so nagnjene k izgubi elektronov. Cink hitreje izgublja elektrone kot baker, zato lahko cink in baker v raztopinah njunih soli povzročita pretok elektronov po zunanji žici, ki vodi od cinka do bakra. Ko atom cinka dobi elektrone, postane pozitiven ion in preide v vodno raztopino, pri čemer se masa cinkove elektrode zmanjša. Na bakrovi strani prejeta dva elektrona omogočita pretvorbo bakrovega iona iz raztopine v nenabit bakrov atom, ki se usede na bakrovo elektrodo in poveča njeno maso. Obe reakciji sta običajno zapisani
Zn(s) --> Zn2+(aq) + 2e
Cu2+(aq) + 2e- --> Cu(s)
Črke v oklepajih so le opomnik, da cink preide iz trdne snovi (s) v vodno raztopino (aq) in obratno za baker. V elektrokemijskem jeziku je značilno, da se ta dva procesa imenujeta "polreakciji", ki potekata na obeh elektrodah.
| Zn(s) -> Zn2+(aq) + 2e |
|
| Cu2+(aq) + 2e- -> Cu(s) |
Da bi voltna celica še naprej proizvajala zunanji električni tok, se morajo sulfatni ioni v raztopini premikati z desne na levo, da se uravnovesi tok elektronov v zunanjem krogu. Kovinskim ionom je treba preprečiti gibanje med elektrodama, zato mora neka porozna membrana ali drug mehanizem zagotoviti selektivno gibanje negativnih ionov v elektrolitu z desne na levo.
Potrebna je energija, da se elektroni premaknejo s cinkove na bakreno elektrodo, količina energije na enoto naboja, ki je na voljo v voltaičnem členu, pa se imenuje elektromotorična sila (emf) člena. Energija na enoto naboja je izražena v voltih (1 volt = 1 džul/kumb).
Jasno je, da je za pridobivanje energije iz celice treba pridobiti več energije, ki se sprosti pri oksidaciji cinka, kot je potrebno za redukcijo bakra. Celica lahko iz tega procesa pridobi končno količino energije, saj je proces omejen s količino razpoložljivega materiala v elektrolitu ali v kovinskih elektrodah. Če je na primer na bakrovi strani en mol sulfatnih ionov SO42-, je proces omejen na prenos dveh molov elektronov skozi zunanji krog. Količina električnega naboja, ki ga vsebuje mol elektronov, se imenuje Faradayeva konstanta in je enaka Avogadrovemu številu, pomnoženemu z elektronskim nabojem:
Faradayeva konstanta = F = ANe = 6,022 x 1023 x 1,602 x 10-19 = 96,485 Kulomba/mola
Energijski izkoristek voltaične celice je podan z napetostjo celice, pomnoženo s številom molekul prenesenih elektronov in Faradayevo konstanto.
Proizvodnja električne energije = nFE
Celični emf E celllahko predvidimo iz standardnih elektrodnih potencialov za obe kovini. Za cink/baker celico v standardnih pogojih je izračunani potencial celice 1,1 volta.
Enostavna celica
Preprosta celica ima običajno plošče iz bakra (Cu) in cinka (Zn) v razredčeni žveplovi kislini. Cink se raztopi, na bakreni ploščici pa se pojavijo mehurčki vodika. Ti vodikovi mehurčki ovirajo pretok električnega toka, zato lahko preprost člen uporabljamo le kratek čas. Za zagotavljanje enakomernega toka je potreben depolarizator (oksidacijsko sredstvo), ki oksidira vodik. V Danielovem členu je depolarizator bakrov sulfat, ki zamenja vodik za baker. V Leclanchevi bateriji je depolarizator manganov dioksid, ki oksidira vodik v vodo.
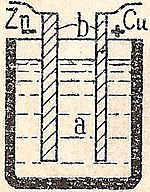
Enostavna celica
Daniel celica
Angleški kemik John Frederick Daniell je leta 1836 razvil voltaično celico, ki je uporabljala cink in baker ter raztopine njunih ionov.
Ključ
- cinkova palica = negativni terminal
- 2HSO4 = elektrolit razredčene žveplove kisline
- Porozna posoda ločuje obe tekočini
- CuSO4 = depolarizator bakrovega sulfata
- Bakreni lonček = pozitivni terminal
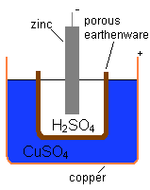
Shema Danielove celice
Vprašanja in odgovori
V: Kaj je kemijska celica in kakšen je njen namen?
O: Kemijska celica je naprava, ki pretvarja kemijsko energijo v električno. Njen namen je proizvesti električni tok s pomočjo kemijske reakcije.
V: Kaj je večina baterij?
O: Večina baterij so kemične celice.
V: Kaj se dogaja v bateriji, da pride do pretoka električnega toka?
O: V bateriji poteka kemijska reakcija, ki povzroči pretok električnega toka.
V: Koliko je vrst baterij in kakšne so?
O: Obstajata dve glavni vrsti baterij - baterije, ki jih je mogoče ponovno napolniti, in baterije, ki jih ni mogoče napolniti.
V: Kaj se zgodi, ko se baterija, ki je ni mogoče ponovno napolniti, izprazni?
O: Baterija, ki je ni mogoče ponovno napolniti, daje električno energijo, dokler se kemikalije v njej ne porabijo. Takrat ni več uporabna in jo lahko zavržemo.
V: Kdo in kdaj je izumil baterije za ponovno polnjenje?
O: Akumulatorske baterije je leta 1859 izumil francoski znanstvenik Gaston Plante.
V: Ali so lahko baterije različnih velikosti in kakšen je primer naprave, ki potrebuje veliko baterijo?
O: Da, baterije so lahko različnih oblik in velikosti. Primer naprave, ki potrebuje veliko baterijo, je podmornica.
Iskati