Baterija: pretvorba kemične v električno energijo — vrste in uporabe
Odkrijte, kako baterije pretvarjajo kemično v električno energijo, vrste (primarne, sekundarne), ključne uporabe ter nasvete za izbiro in polnjenje — od mobilnikov do električnih vozil.
Baterija s kemično reakcijo pretvarja kemično energijo v električno. V notranjosti so kemikalije, elektrode in elektrolit, ki ob kemijskih pretvorbah proizvajajo proste elektrone; ti v zunanjih vezju tečejo kot električni tok in napajajo druge komponent. Baterija običajno proizvaja enosmerni električni tok (DC), kar pomeni, da električni tok teče v eni smeri.
Uporaba električne energije iz vtičnice v stavbi je pogosto cenejša in učinkovitejša za dolgoročno napajanje, vendar baterije omogočajo električno energijo tudi na območjih brez električnega omrežja in so nepogrešljive za prenosne naprave ter sisteme v gibanju, kot so električna vozila ali mobilni telefoni.
Baterije so lahko primarne ali sekundarne. Primarne (enkratne) baterije zavržemo, ko jih porabimo, medtem ko so sekundarne baterije ponovno poljljive — lahko jih napolnimo in uporabimo večkrat.
Kako baterija deluje
Baterija sestoji iz dveh elektrod (anoda in katoda) in elektrolita. Med raztapljanjem ali kemijo na elektrodah poteka redoks reakcija: ena elektroda sprošča elektrone (oksidacija), druga jih sprejema (redukcija). Elektroni tečejo skozi zunanji krogotok od anode do katode, kar daje uporaben električni tok. Znotraj baterije ionski tok skozi elektrolit uravnava izenačevanje nabojev.
Vrste baterij
- Primarne baterije: alkalne (AA, AAA), cink-ogljikove, primarne litijeve (za visok energetski izkoristek in dolgo življenjsko dobo v majhnih tokovih).
- Sekundarne (polnilne) baterije: svinčevo-kislinske (lead-acid) za avtomobile in UPS sisteme; nikl-kadmijeve (NiCd), nikl-metal-hidridne (NiMH) za starejše prenosne naprave; litij-ionske (Li-ion) in litij-polimerne (LiPo) za prenosno elektroniko in električna vozila; tudi napredne rešitve kot so tekočinske (flow) in trdne (solid-state) baterije.
- Velikosti in nominalne napetosti: standardne celice AA/AAA ~1,5 V (pri alkalnih), NiMH/NiCd ~1,2 V na celico, Li-ion celice ~3,6–3,7 V, svinčevo-kislinske celice ~2,0 V na člen (12 V akumulator = 6 členov).
Glavne značilnosti in zmogljivosti
- Kapaciteta: običajno izražena v mAh ali Ah (milliampere-ure oziroma amper-ure) — pove, koliko toka lahko baterija oddaja v določenem času.
- Energija: Wh (vatna-ura) = napetost × kapaciteta; pomembna za primerjavo različnih napetostnih sistemov.
- Notranja upornost: vpliva na izgube energije in sposobnost da baterija oddaja visoke tokove (močna baterija ima nizko notranjo upornost).
- C-rate: hitrost polnjenja/razpolnjenja glede na kapaciteto (npr. 1C pomeni polnjenje/razpolnjenje v eni uri).
- Življenjski cikli: število polnitev/izpraznitev pri katerih baterija ohranja sprejemljivo kapaciteto — Li-ion pogosto 300–2000 ciklov, NiMH/NiCd manj, svinčene akumulatorje merimo drugače.
- Samoizpraznitev in temperatura: baterije se sčasoma praznijo same (različne stopnje glede na kemijo) in njihova učinkovitost ter življenjska doba sta občutni na temperaturo.
Uporabe
Baterije pokrivajo širok spekter uporabe:
- prenosne naprave (telefoni, računalniki, prenosne igrače),
- električna vozila in e-kolesa (električna vozila),
- rezervno napajanje in UPS sistemi za kritične aplikacije,
- stacionarno shranjevanje energije za omrežje in sončne sisteme,
- medicinska oprema in prenosne zasnovane naprave,
- vsakodnevne majhne naprave — mobilni telefoni, daljinski upravljalniki, svetilke ipd.
Polnjenje in vzdrževanje
- Različne kemije zahtevajo različne postopke polnjenja: Li-ion telefoni in prenosniki običajno uporabljajo CC-CV (constant current–constant voltage), svinčevo-kislinski akumulatorji imajo float in equalization načine, NiCd pa so občutljivi na »memory effect« pri nepravilnem polnjenju.
- Za podaljšanje življenjske dobe se svetuje: izogibanje popolnim izpraznitvam (pri Li-ion), shranjevanje pri zmerni napolnjenosti (približno 40–60 % za dolgoročno skladiščenje Li-ion), zaščita pred visokimi temperaturami.
- Upoštevajte navodila proizvajalca glede hitrosti polnjenja in primerne temperature med polnjenjem.
Varnost in recikliranje
Baterije lahko predstavljajo potencialno nevarnost: pri nepravilnem ravnanju ali poškodbah lahko pride do kratkega stika, požara ali termične pobude (thermal runaway), zlasti pri nekaterih litij-ionskih celicah. Svinčevo-kislinske baterije vsebujejo živo in kislino, ki sta okolju škodljiva.
Zato je pomembno:
- uporabljati in polniti le primerno certificirane baterije in polnilce,
- ne poškodovati baterij, ne izpostavljati jih ekstremnim temperaturam,
- odpadne baterije oddajati v zbirne centre za recikliranje — recikliranje omogoča vračanje kovin in zmanjšuje okoljski vpliv.
Skupaj baterije omogočajo mobilnost, rezervno napajanje in shranjevanje energije, hkrati pa prinašajo zahtevno ravnanje in recikliranje. Pri izbiri baterije upoštevajte njeno kemijo, zmogljivost, težo, varnostne zahteve in vpliv na okolje.
Shematski simbol baterije

Kemija v bateriji
Baterija je lahko sestavljena iz ene ali več celic. Vsaka celica ima anodo, katodo in elektrolit. Elektrolit je glavni material v bateriji. Pogosto gre za vrsto kisline, ki je lahko nevarna za dotik. Anoda reagira z elektrolitom in proizvaja elektrone (to je negativni ali - konec). Katoda reagira z elektrolitom in sprejema elektrone (to je pozitivni ali + konec). Električni tok nastane, ko žica poveže anodo in katodo, elektroni pa se premikajo z enega konca na drugega. (Toda baterijo lahko poškodujemo že z žico, ki povezuje oba konca, zato je med obema koncema potrebna tudi obremenitev. Obremenitev je nekaj, kar upočasni elektrone in običajno naredi nekaj koristnega, kot je žarnica v svetilki ali elektronika v kalkulatorju).Elektrolit je lahko tekoči ali trdni. Glede na vrsto elektrolita se baterija imenuje baterija z mokrimi ali suhimi celicami.
Kemijske reakcije, ki potekajo v bateriji, so eksotermne reakcije. Pri tej vrsti reakcij nastaja toplota. Če na primer pustite prenosni računalnik dalj časa vklopljen in se nato dotaknete baterije, bo ta topla ali vroča.
Akumulatorska baterija se polni z obratno kemično reakcijo, ki poteka v bateriji. Vendar lahko akumulatorsko baterijo napolnimo le določeno številokrat (doba polnjenja). Tudi vgrajenih baterij ni mogoče polniti v nedogled. Poleg tega se z vsakim polnjenjem baterije njena zmožnost ohranjanja napolnjenosti nekoliko zmanjša. Baterij, ki jih ni mogoče ponovno napolniti, ne smete polniti, saj lahko iz njih iztečejo različne škodljive snovi, na primer kalijev hidroksid.
Celice je mogoče povezati v večjo baterijo. Povezovanje pozitivne celice z negativno celico naslednje celice se imenuje zaporedno povezovanje. Napetosti posameznih baterij se seštejejo. Dve zaporedno povezani šestvoltni bateriji bosta imeli 12 voltov.
Povezovanje pozitivne celice s pozitivno celico druge celice in negativne z negativno se imenuje vzporedno povezovanje. Napetost ostane enaka, vendar se tok sešteje. Napetost je pritisk, ki potiska elektrone skozi žice, in se meri v voltih. Tok je število elektronov naenkrat, meri se v amperih. Kombinacija toka in napetosti je moč (vati = volti x amperi) baterije.
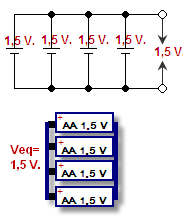
Vzporedno povezane baterije - prikazano na shemi in risbi
Velikosti baterij
Baterije so različnih oblik, velikosti in napetosti.Baterije AA, AAA, C in D, vključno z alkalnimi baterijami, so standardnih velikosti in oblik ter imajo približno 1,5 volta. Napetost celic je odvisna od uporabljenih kemikalij. Električni naboj, ki ga lahko zagotovi, je odvisen od tega, kako velika je celica in katere kemikalije. Električni naboj baterije se običajno meri v amperskih urah. Ker napetost ostaja enaka, več naboja pomeni, da lahko večja celica zagotavlja več amperov ali deluje dlje časa.
Zgodovina
Prva baterija je bila izumljena v 1800 Alessandro Volta. Danes njegovo baterijo imenujemo voltaična baterija.V majhnih sodobnih baterijah je tekočina imobilizirana v neke vrste pasti, vse skupaj pa je shranjeno v zaprtem ohišju. Zaradi tega ohišja se iz baterije ne more nič razliti. Večji akumulatorji, kot so avtomobilski akumulatorji, imajo v sebi še vedno tekočino in niso zaprti. Med drugo svetovno vojno je bila izumljena vrsta baterije, ki kot elektrolit uporablja staljene soli.
Vrste baterij
- suhe celice, celice, ki kot elektrolit ne vsebujejo tekočine (ali vsebujejo imobilizirano tekočino, na primer pasto ali gel)
- Primarna celica, celice, ki jih ni mogoče ponovno napolniti
- Alkalna baterija, "alkalna", ni za ponovno polnjenje
- Baterija iz živega srebra, ki je ni mogoče ponovno napolniti
- Baterija Leclanche, "super heavy duty", ni za ponovno polnjenje
- Litijeva baterija, ki je ni mogoče ponovno napolniti, "kronska celica"
- Baterija iz srebrovega oksida, ki je ni mogoče ponovno napolniti, baterija za uro
- Voltaic kup, prva baterija Allesandra Voltasa
- Sekundarna celica, celice, ki jih je mogoče ponovno napolniti
- Zaprta svinčeno-kislinska baterija
- Litij-ionska baterija, ki jo je mogoče ponovno napolniti, se uporablja v mobilnih telefonih in prenosnih računalnikih.
- Nikelj-kadmijeva baterija, "NiCd", za ponovno polnjenje
- Nikelj-metalhidridna baterija, "NiMH", za ponovno polnjenje
- Nikelj-cinkova baterija
- mokre celice, celice, ki vsebujejo tekočino kot elektrolit.
- Svinčevo-kislinski akumulator, akumulatorski, avtomobilski akumulator
- Nikelj-železova baterija, za ponovno polnjenje, Edisonova baterija
- Gorivna celica, ki se polni z dodajanjem goriva

Pogled na zgornji del avtomobilskega akumulatorja
Alternative baterijam
Gorivne in sončne celice niso baterije, ker v njih ni shranjena energija.Kondenzator ni baterija, ker ne shranjuje energije v kemični reakciji. Kondenzator lahko shranjuje električno energijo in jo ustvarja veliko hitreje kot baterija, vendar je običajno predrag, da bi ga naredili tako velikega, kot je lahko baterija. Znanstveniki in kemijski inženirji si prizadevajo izdelati boljše kondenzatorje in baterije za električne avtomobile.
Majhni električni generatorji, ki se upravljajo ročno ali z nogami, lahko napajajo majhne električne naprave. Tudi radijski sprejemniki z urnim mehanizmom, svetilke z urnim mehanizmom in podobne naprave imajo navijalno vzmet za shranjevanje mehanske energije.
Vprašanja in odgovori
V: Kaj je baterija?
O: Baterija je naprava, ki s kemično reakcijo pretvarja kemično energijo v električno.
V: Kako baterija proizvaja električno energijo?
O: Baterija proizvaja enosmerni električni tok (DC), ki teče v eni smeri in se ne preklaplja sem in tja.
V: Kje so shranjene kemikalije v bateriji?
O: Običajno so kemikalije v notranjosti baterije.
V: Kakšna je razlika med primarno in sekundarno baterijo?
O: Primarno baterijo zavržemo, ko ne more več zagotavljati električne energije, medtem ko lahko sekundarno baterijo ponovno napolnimo in uporabimo.
V: Zakaj so baterije koristne?
O: Baterije so uporabne za zagotavljanje električne energije na območjih, kjer ni distribucije električne energije, in za stvari, ki se premikajo, kot so električna vozila in mobilni telefoni.
V: Ali je uporaba električne energije iz vtičnice v stavbi cenejša in učinkovitejša od uporabe baterije?
O: Da, uporaba električne energije iz vtičnice v stavbi je cenejša in učinkovitejša kot uporaba baterije.
V: Kakšno vrsto električne energije proizvaja baterija?
O: Baterija proizvaja enosmerni tok (DC).
Iskati