Absolutna ničla — definicija, fizikalni pomen in enote (0 K, -273,15 °C)
Absolutna ničla: kaj pomeni 0 K (-273,15 °C), kvantni pomen in energija ničelne točke, kako blizu so raziskave ter razlaga enot in fizikalnih posledic.
Kaj je absolutna ničla?
Absolutna ničla je meja termodinamične temperature, pri kateri sistem doseže svoj najnižji možni energijski prazen ali osnovni (ground) položaj. Pri tej temperaturi bi v idealnem klasičnem pogledu kinetična energija delcev padla na nič, vendar v kvantni fiziki ne morejo delci popolnoma izgubiti vse energije. Obstaja namreč energija ničelne točke, ki izhaja iz Heisenbergovega načela negotovosti: če bi bil položaj delca povsem znan (delca popolnoma ustavimo), bi bila negotovost v gibalni količini neskončna in to ni skladno s kvantnimi zakoni. Zato imajo delci tudi pri zelo nizkih temperaturah še vedno neko osnovno nihanje ali ničelno gibanje.
Kaj se zgodi pri približevanju k absolutni ničli?
Pri približevanju 0 K se termalne motnje in število ekscitiranih kvantnih stanj zmanjšujeta. V preprostem statističnem pogledu pri temperaturi zelo blizu 0 K skoraj ves sistem zasede svoj osnovni kvantni nivo; razporeditev Boltzmannovih verjetnosti postane izjemno ostra. To je tudi razlog, da pri nizkih temperaturah nastajajo kvantni pojavi, kot so Bose–Einsteinov kondenzat ali superprevodnost (v materialih, ki so za to sposobni), kjer se vedenje snovi močno razlikuje od klasičnih pričakovanj.
Nekateri raziskovalci so dosegli rekordne temperature reda 100 pK (sto pikokelvinov, enako 10-10 K) nad absolutno ničlo. Doseganje takih temperatur je tehnično zahtevno: vsak stik s toplejšim objektom prenaša toploto nazaj v ohlajeni vzorec. Zato pri eksperimentih uporabljajo velike vakuumske komore, magnetne in optične pasti ter kombinacijo tehnik, kot so laserje za upočasnitev atomov, evaporativno hlajenje, simpatetično hlajenje in adiabatska demagnetizacija (za trdne snovi).
Temperaturne lestvice in enote
Kelvinova lestvica je osnovna SI-enota za temperaturo; absolutna ničla je definirana kot 0 kelvinov (0 K). Na Rankinovi lestvici je absolutna ničla 0 stopinj Rankina (0 °R). Razmerje med običajnimi skalami je:
- K = °C + 273,15
- °R = °F + 459,67
- K = °R × 5/9
Torej sta na Celzijevi in Fahrenheitovi lestvici absolutni ničli ustrezata vrednosti približno −273,15 °C oziroma −459,67 °F.
Fizikalni pomen pri nizkih temperaturah
V idealnem klasičnem plinu bi tlak delcev upadel z zmanjševanjem temperature in pri 0 K teoretično dosegel nič, ker kinetična energija delcev pada na nič. V realnih sistemih pa kvantni učinki lahko povzročijo drugačno obnašanje: npr. degeneracijski tlak elektronov v zgoščenih sistemih (Posledica Paulijevega izključitvenega principa) ostaja nenaklonjen popolnemu propadu tlaka. Prav tako ne postanejo vsi materiali brez upora; le nekateri materiali se pri kritičnih temperaturah spremenijo v superprevodnike, pri katerih je odpornost električnega toka praktično nič pod merljivo mejo.
Pomembno je razumeti tudi, da ne moremo "obrnjeno" pomikati gibanja delcev — pri 0 K enostavno ni termalne energije za ekscitacijo v nižje stanje; nihanja, ki ostanejo, so kvantne narave (npr. kvantne nihaje v kristalni rešetki, tj. fononi), ne pa klasično "vzvratno gibanje".
Termodinamične omejitve
Tretji zakon termodinamike v eni formulaciji (Nernstov izrek) pravi, da entropija čiste, idealne kristalne snovi pri 0 K doseže konstantno minimalno vrednost in da absolutne ničle ni mogoče doseči z nobenim postopkom s končnim številom korakov (princip nedosegljivosti). Zato je doseganje točno 0 K praktično in teoretično nemogoče.
Drugi zakon termodinamike povezuje delovanje toplotnih strojev z razlikami temperatur: za idealni Carnotov krog je največja možna učinkovitost dana z izrazom η = 1 − T_c/T_h, kjer sta T_c (hladna rezerva) in T_h (topla rezerva) izraženi v absolutnih temperaturah (kelvinih). Če bi bila T_c enaka 0 K, bi bila η = 1 (100 %), vendar je T_c = 0 K nedosegljiva, zato praktično ni mogoče zgraditi toplotnega stroja s popolno izkoriščenostjo. V praksi lahko učinkovitost povečujemo z zviševanjem notranje (vroče) temperature in/ali znižanjem zunanje (hladne) temperature, vendar ne do popolne 100‑odstotne vrednosti.
Dodatne opombe
V nekaterih kvantnih sistemih z omejenim višjim energijskim nivojem se v termodinamičnem smislu pojavi pojem negativne temperature na Boltzmannovi lestvici — to pa ne pomeni, da so ti sistemi "hladnejši" od 0 K; namesto tega gre za posebne populacijske inverzije, pri katerih toplota in drugi termodinamični koncepti zahtevajo previdno interpretacijo. Za vsakdanjo fiziko in večino materialov pa ostaja 0 K spodnja meja, ki je ni mogoče doseči.
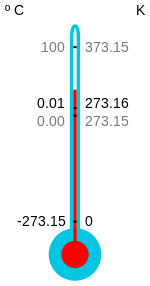
Nič kelvinov (-273,15 °C) je definirano kot absolutna ničla.
Sorodne strani
- Absolutna temperatura
- Absolutno vroče
Vprašanja in odgovori
V: Kaj je absolutna ničla?
O: Absolutna ničla je temperatura, pri kateri imajo delci snovi (molekule in atomi) najnižjo energijo.
V: Ali absolutna ničla pomeni, da delci izgubijo vso energijo in se nehajo gibati?
O: Ne, v kvantni fiziki obstaja nekaj, kar se imenuje energija ničelne točke, kar pomeni, da imajo delci tudi po tem, ko je bila delcem odvzeta vsa energija, še vedno nekaj energije zaradi Heisenbergovega načela negotovosti.
V: Katera je rekordna temperatura, dosežena blizu absolutne ničle?
O: Rekordna temperatura je bila 100 pK (sto pikokelvinov, enako 10-10 kelvinov) nad absolutno ničlo.
V: Kako znanstveniki ohladijo predmete na zelo nizke temperature?
O: Znanstveniki pri ohlajanju predmetov na zelo nizke temperature uporabljajo laserje, ki upočasnijo atome.
V: Kako sta Celzijeva in Fahrenheitova lestvica opredeljeni glede na absolutno ničlo?
O: Celzijeva in Fahrenheitova lestvica sta definirani tako, da je absolutna ničla -273,15 °C ali -459,67 °F.
V: Kaj pravi tretji zakon termodinamike o absolutni ničli?
O: Tretji zakon termodinamike pravi, da nič ne more imeti temperature absolutne ničle.
V: Kako lahko učinkovitost motorja povečamo na skoraj 100 %?
O: V skladu z drugim zakonom termodinamike lahko učinkovitost motorja povečamo na 100 %, če je notranja temperatura motorja višja in/ali zunanja temperatura nižja.
Iskati