Zlaganje beljakovin: definicija, stopnje, mehanizem in bolezni
Zlaganje beljakovin: definicija, stopnje, mehanizem in bolezni — razumite, kako pravilno zlaganje določa funkcijo beljakovin, zakaj pride do napak ter kako to vodi do bolezni in alergij.
Zlaganje beljakovin je proces, v katerem beljakovina dobi svojo funkcionalno obliko ali "konformacijo". Gre predvsem za samoorganizacijski proces. Polipeptidi se iz naključnega zvitka zložijo v svojo značilno delovno obliko. Strukturo držijo skupaj vodikove vezi.
Stopnje so naslednje:
- Vsaka beljakovina obstaja v obliki razpotegnjenega polipeptida ali naključne vijačnice, ko je prevedena iz zaporedja mRNA v linearno verigo aminokislin. Ta polipeptid nima razvite tridimenzionalne strukture (leva stran zgornje slike).
- Aminokisline medsebojno delujejo, da nastanejo dobro definirane tridimenzionalne strukture, zložene beljakovine (desna stran slike). To je znano kot nativno stanje. Nastalo tridimenzionalno strukturo določa zaporedje aminokislin (Anfinsenova dogma).
Brez pravilne tridimenzionalne strukture beljakovina ne deluje. Vendar se nekateri deli beljakovin ne morejo zložiti: to je normalno.
Če se beljakovine ne zložijo v svojo prvotno obliko, so neaktivne in običajno strupene. Več bolezni naj bi bilo posledica napačno zloženih beljakovin. Številne alergije so posledica prepogibanja beljakovin, saj imunski sistem ne proizvaja protiteles za vse možne strukture beljakovin.
Strukturne stopnje zlaganja
- Primarna struktura: zaporedje aminokislin v polipeptidni verigi, določeno z DNK/mRNA. To zaporedje usmerja vse nadaljnje stopnje zlaganja.
- Sekundarna struktura: lokalne konformacije, kot sta α–vijačnica in β–ploskev, ki jih stabilizirajo predvsem vodikove vezi.
- Tercierna struktura: celovita tridimenzionalna oblika posamezne polipeptidne verige; nanjo vplivajo hidrofobne interakcije, ionske vezi, disulfidni mostički in van der Waalsove sile.
- Kvarternska struktura: združevanje več polipeptidnih enot (substncev) v funkcionalen kompleks (npr. hemoglobin).
Mehanizem zlaganja
Zlaganje je proces, v katerem polipeptidni veriči sledijo energijskemu peklenu (energy landscape) proti najnižje energijskemu nativnemu stanju. Pri tem pogosto nastajajo prehodne oblike, imenovane folding intermediates ali "molten globule". Za pravilno zgradbo so pomembne različne kemijske sile: vodikove vezi, hidrofobne interakcije, ionske vezi in disulfidni mostički. Anfinsenova dogma (naveden v zgornjem seznamu) poudarja, da zaporedje aminokislin vsebuje informacije, potrebne za dosego nativne konfiguracije, a v celici pogosto potrebuje pomoč.
Molekularni pomočniki pri zlaganju
V celici zlaganje olajšajo specializirane proteine in encimi:
- Hsp70, Hsp90 in druge toplote šok proteine (heat-shock proteins): vežejo delno zložene verige, preprečujejo nepotrebno agregacijo in pomagajo pri pravilnem prepletanju.
- Chaperonini (npr. GroEL/GroES): nudijo izolirano okolje, kjer se lahko polipeptid varno zloži.
- Foldaze in izomeraze: npr. peptidil-prolil izomeraze in protein disulfid izomeraza (PDI), ki pospešijo nastanek ustreznih vezav in izomerizacije.
- Vezanje kofaktorjev ali kovinskih ionov: za stabilizacijo prave konformacije mnogih beljakovin.
Nekatere beljakovine so intrinzično neuravnotežene (intrinsically disordered) in delujejo brez stalne tridimenzionalne strukture; pri njih je fleksibilnost funkcionalna lastnost.
Nepravilno zlaganje in bolezni
Ko zlaganje odpove ali se pojavi nenadzorovana agregacija, nastanejo toksčne vrste ali fibrili (npr. amiloidi). Takšne napake so povezane z večimi boleznimi:
- Prionske bolezni (npr. Creutzfeldt–Jakobova bolezen) – prionski protein se spremeni v infekcijsko, agregatno obliko.
- Alzheimerjeva bolezen – tvorba β-amiloidnih peptidnih agregatov in tau nevrofibrilarnih storžev.
- Parkinsonova bolezen – agregacija α-sinukleina v Lewyjevih telescih.
- Huntingtonova bolezen – nenormalno razširjene polyQ verige povzročajo agregacijo beljakovin.
- Systemska ali lokalna amiloidoza – kopičenje različni amiloidnih proteinov v tkivih.
- Cistična fibroza – napačno zložena mutirana oblika transportnega proteina CFTR, kar vodi v njegovo degradacijo in izgubo funkcije.
- Tip 2 diabetes – agregacija amilina v pankreasu.
Poleg bolezni, omenjenih zgoraj, lahko nepravilno zlaganje vpliva tudi na imunske odzive in alergijske reakcije; kot je opisano v zgornjem delu, alergije so v nekaterih primerih posledica nenavadnih konformacij, ker imunski sistem ne proizvaja protiteles za vse možne strukture beljakovin.
Celjski mehanizmi nadzora in terapije
Celice imajo več mehanizmov za prepoznavanje in odstranjevanje napačno zloženih beljakovin:
- Unfolded Protein Response (UPR): signalni sistem v endoplazemskem retikulumu, ki odziva na kopičenje nezloženih beljakovin z zmanjšanjem sinteze, povečanjem kapacitete za zlaganje in, če je potrebno, sprožitvijo apoptoze.
- ER-associated degradation (ERAD): prenese napačno zložene beljakovine iz ER v citosol, kjer jih označijo z ubikvitinom in degradirajo preko proteasoma.
- Avtofagija: odstranjuje večje agregate, ki jih proteasom ne zmore razgraditi.
Terapije v raziskavah in klinično vključujejo droge, ki stabilizirajo nativno konformacijo (molekularni stabilizatorji), majhne molekule, ki delujejo kot chaperoni, imunoterapije proti agregatom, antisense oligonukleotide za zmanjšanje sinteze patogenih beljakovin in pristopi, ki ciljajo na izboljšanje proteostatskih poti.
Metode za preučevanje zlaganja
Zlaganje in agregacijo proučujemo z različnimi biokemijskimi in biološkimi tehnikami:
- Spektroskopije (CD, FTIR) za spremljanje sekundarnih struktur.
- Fluorescenčne metode in single-molecule FRET za opazovanje kinetike zlaganja.
- NMR, rentgenska kristalografija in cryo-EM za določanje 3D struktur.
- Thioflavin T in Congo red testi za detekcijo amiloidnih fibrilov.
- Proteomske metode, masna spektrometrija in biokemijski testi stabilnosti.
Zaključek
Zlaganje beljakovin je ključen, dinamičen proces, ki povezuje informacije v zaporedju aminokislin z njihovo funkcijo. Celice uporabljajo kompleksno mrežo pomožnih proteinov in nadzornih mehanizmov, da zagotavljajo pravilno zlaganje in odstranjevanje napak. Razumevanje teh procesov je osnovno za razumevanje številnih bolezni in razvoj novih terapevtskih pristopov.
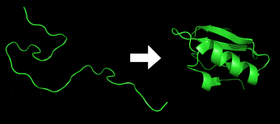
Beljakovine pred in po prepogibanju
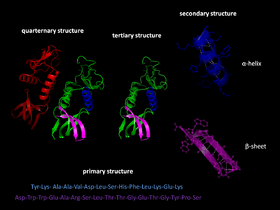
Zlaganje proteinov je tretja stopnja v razvoju strukture proteinov.
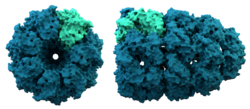
Struktura šaperonina. Šaperonini pomagajo pri zgibanju nekaterih beljakovin.
Šaperoni
Šaperonini so velike beljakovine, ki pomagajo pri zlaganju nekaterih beljakovin po sintezi. Na splošno so najprej odkrili, da šaperoni pomagajo histonom in DNK pri povezovanju v nukleosome. Nukleosomi so gradniki kromosomov. Zdaj je jasno, da so na ta način zgrajeni številni celični organeli.
Vprašanja in odgovori
V: Kaj je zlaganje beljakovin?
O: Zlaganje beljakovin je proces, pri katerem se polipeptidna veriga spremeni iz razvite linearne verige aminokislin v svojo značilno tridimenzionalno obliko.
V: Kaj drži strukturo skupaj?
O: Strukturo zloženega proteina držijo skupaj vodikove vezi.
V: Katere so faze zlaganja beljakovin?
O: Stopnje zlaganja beljakovin vključujejo nezložen polipeptid ali naključno vijačnico, ko se prevede iz mRNA v linearno verigo aminokislin in nato medsebojno sodeluje, da nastane dobro definirana tridimenzionalna struktura, znana kot nativno stanje.
V: Kaj se zgodi, če se beljakovine ne zložijo pravilno?
O: Če se beljakovine ne zložijo v svojo nativno obliko, so neaktivne in običajno strupene. To lahko privede do več bolezni in alergij, ki jih povzročajo nepravilno zložene beljakovine, ki jih imunski sistem ne prepozna.
V: Kdo je leta 2020 rešil problem zlaganja beljakovin?
O: 30. novembra 2020 je problem zlaganja beljakovin rešilo podjetje DeepMind, ki se ukvarja z umetno inteligenco.
V: Kaj je Anfinsenova dogma? O: Anfinsenova dogma pravi, da je dobljena tridimenzionalna struktura zloženega proteina določena z aminokislinskim zaporedjem.
Iskati