Aminokislina – definicija, funkcije, vrste in esencialne aminokisline
Aminokisline razložene jasno in jedrnato, od strukture in funkcij do vrst ter 9 esencialnih aminokislin, pomembne za beljakovine in uravnavanje zdravja
Aminokisline so osnovni gradniki beljakovin. Pri evkariontih je 20 standardnih aminokislin, iz katerih so sestavljene skoraj vse beljakovine v živih organizmih. V biokemiji je aminokislina vsaka molekula, ki ima tako aminsko (NH2+R) kot karboksilno (C=O) funkcionalno skupino. V biokemiji se ta izraz nanaša predvsem na alfa-aminokisline s splošno formulo H2NCHRCOOH, kjer je R različna stranska skupina (glej diagram).
Struktura in kemijske lastnosti
Vsaka aminokislina ima centralni ogljikov atom (alfa-ogljik), vezan na:
- aminsko skupino (–NH2),
- karboksilno skupino (–COOH),
- vodikov atom (–H) in
- stransko skupino R, ki določa kemijske in fizikalne lastnosti aminokisline.
Stranske skupine R so zelo raznolike: nepolarne (npr. alanin, levcin), polarne nevtralne (npr. serin, treonin), kisle (npr. asparaginska, glutaminska) in bazične (npr. lizin, arginin). Ta raznolikost omogoča veliko različnih interakcij v beljakovinskih strukturah in funkcijah.
Strukturni nivoji beljakovin
Aminokisline se povezujejo s peptidnimi vezmi v dolge verige (polipeptide). Zaporedje aminokislin tvori primarno strukturo beljakovine. Nadaljnje ureditve vključujejo:
- sekundarno strukturo (alfa vijačnice, beta-listi),
- terciarno strukturo (prostorska zložitev polipeptida) in
- kvartarno strukturo (sestavljanje več polipeptidnih verig v funkcionalne komplekse).
Funkcije aminokislin
Aminokisline niso pomembne le kot gradniki beljakovin; opravljajo tudi druge ključne vloge:
- predhodniki nevrotransmiterjev in hormonov (npr. triptofan → serotonin, tirozin → dopamin, noradrenalin, adrenalin);
- upravlja presnovo kot substrati za sintezo nukleotidov, purinov in pirimidinov;
- vloga v transportu in skladiščenju dušika (npr. glutamin, alanin);
- vključenost v metabolne poti (gluconeogeneza – tvorba glukoze iz aminokislin med postom);
- strukturne funkcije (kolagen, elastin),
- katalitične (aminokisline so sestavni del encimov) in
- imunološke funkcije (protitelesa).
Vrste aminokislin in posebnosti
Poznamo približno 500 različnih aminokislin v naravi, vendar je le okoli 20 standardnih alfa-aminokislin kodiranih v univerzalnem genetskem kodu in vgrajenih v beljakovine v procesu translacije. Poleg teh dveh so v nekaterih organizmih prisotni tudi posebni vgrajeni aminokislini, kot sta selenocistein in pirrolizina, ki se vgrajujeta zizemlje posebnimi mehanizmi. Poleg tega se aminokisline pogosto kemično spreminjajo po translaciji (post-translacijske modifikacije), kar dodatno povečuje raznolikost.
Pomembna lastnost aminokislin je tudi kiralnost: pri naravnih beljakovinah prevladujejo L-aminokisline, medtem ko so D-oblike redke in se pojavljajo npr. v nekaterih bakterijskih peptidih.
Esencialne aminokisline
Devet od 20 standardnih aminokislin je za odraslega človeka esencialnih, kar pomeni, da jih telo ne more učinkovito sintetizirati iz drugih spojin in jih je treba pridobiti s hrano. Te aminokisline so (za odrasle):
- histidin,
- izolevcin,
- levcin,
- lizin,
- metionin,
- fenilalanin,
- treonin,
- triptofan in
- valin.
Za dojenčke in otroka so lahko določene aminokisline (npr. arginin, histidin) pogojno esencialne, torej ključne v obdobjih hitre rasti ali pri določenih bolezenskih stanjih. Esencialnost se lahko razlikuje tudi med različnimi vrstami živali: rastlinojedi morajo esencialne aminokisline pridobiti iz prehrane, ki je pri nekaterih vrstah skoraj v celoti trava, medtem ko prežvekovalci, kot so krave, nekatere aminokisline dobijo z mikrobi v prvih dveh komorah želodca.
Prehranski viri in pomanjkanje
Vzdrževanje zadostnega vnosa vseh esencialnih aminokislin je pomembno za rast, obnovo tkiv in imunsko funkcijo. Dobri viri popolnih beljakovin (torej z vsemi esencialnimi aminokislinami) so meso, ribe, jajca in mlečni izdelki. Nekatere rastlinske beljakovine, npr. soja in kvinoja, so prav tako skoraj popolne. Pri rastlinski prehrani je smiselno kombinirati različne vire (npr. stročnice + žita), ker imajo različne profile aminokislin in se lahko medsebojno dopolnjujejo.
Pomanjkanje esencialnih aminokislin vodi v zmanjšano sintezo beljakovin, izgubo mišične mase, slabitev imunskega sistema in druge motnje v rasti in regeneraciji. Prekomerni vnos posameznih aminokislin ali dodatkov lahko prav tako povzroči neželene učinke, zato je priporočljivo uravnoteženo prehranjevanje in po potrebi posvet z zdravstvenim strokovnjakom.
Dodatne zanimivosti
- Genetski kod določa, katera zaporedja nukleotidov (kodoni) ustrezajo določeni aminokislini, zato sprememba enega nukleotida v genu lahko povzroči zamenjavo aminokisline in s tem spremenjeno funkcijo beljakovine.
- Poleg vgrajenih 20 standardnih aminokislin obstajajo številne netradicionalne in modificirane aminokisline, ki imajo specializirane vloge v metabolizmu ali obrambi proti mikrobom.
- Aminokisline se merijo s specifičnimi analizami (npr. HPLC) v biokemiji in klinični diagnostiki, kjer lahko motnje v presnovi aminokislin kažejo na dedne presnovne bolezni.
Na kratko: aminokisline so ključna skupina molekul, ki omogoča gradnjo in delovanje vseh beljakovin ter sodeluje v številnih presnovnih in signalnih procesih. Čeprav obstaja le omejeno število standardnih aminokislin, njihova kombinatorika in kemične lastnosti ustvarjajo izjemno biološko raznolikost.
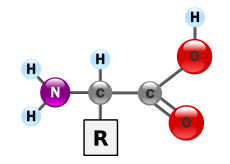
Aminokisline so končni produkt beljakovin.Splošna zgradba α-aminokisline z aminoskupino na levi in karboksilno skupino na desni.
Struktura
Aminokislina je organska kemikalija. Sestavljena je iz ogljikovega atoma α, ki je kovalentno vezan na štiri skupine.
- atom vodika
- aminoskupino (-NH2)
- karboksilna skupina (-COOH)
- skupina spremenljivk R
Vsaka aminokislina ima vsaj eno aminoskupino (-NH2) in eno karboksilno skupino (-COOH), razen prolina.
Izražanje genov in biokemija
To so proteinogene aminokisline, ki so gradniki beljakovin. Proizvajajo jih celični stroji, ki so kodirani v genetski kodi vsakega organizma.
| Aminokislina | Kratek | Skrajšano. | Kodon(-i) | Pojavnost v | Essential‡ pri ljudeh |
| A | Ala | GCU, GCC, GCA, GCG | 7.8 | Ne | |
| C | Cys | UGU, UGC | 1.9 | Pogojno | |
| Asparaginska kislina | D | Asp | GAU, GAC | 5.3 | Ne |
| Glutaminska kislina | E | Glu | GAA, GAG | 6.3 | Pogojno |
| Fenilalanin | F | Phe | UUU, UUC | 3.9 | Da |
| Glicin | G | Gly | GGU, GGC, GGA, GGG | 7.2 | Pogojno |
| Histidin | H | Njegova | CAU, CAC | 2.3 | Da |
| Izolevcin | I | Ile | AUU, AUC, AUA | 5.3 | Da |
| Lizin | K | Lys | AAA, AAG | 5.9 | Da |
| Levcin | L | Leu | UUA, UUG, CUU, CUC, CUA, CUG | 9.1 | Da |
| Metionin | M | Met | AUG | 2.3 | Da |
| Asparagin | N | Asn | AAU, AAC | 4.3 | Ne |
| Pirolizin | O | Pyl | UAG* | 0 | Ne |
| Proline | P | Pro | CCU, CCC, CCA, CCG | 5.2 | Ne |
| Glutamin | Q | Gln | CAA, CAG | 4.2 | Ne |
| Arginin | R | Arg | CGU, CGC, CGA, CGG, AGA, AGG | 5.1 | Pogojno |
| Serin | S | Ser | UCU, UCC, UCA, UCG, AGU, AGC | 6.8 | Ne |
| Treonin | T | Thr | ACU, ACC, ACA, ACG | 5.9 | Da |
| Selenocistein | U | Sec | UGA** | >0 | Ne |
| Valine | V | Val | GUU, GUC, GUA, GUG | 6.6 | Da |
| W | Trp | UGG | 1.4 | Da | |
| Y | Tyr | UAU, UAC | 3.2 | Pogojno | |
| Stop kodon† | - | Termin | UAA, UAG, UGA†† | - | - |
* UAG je običajno jantarni stop kodon, vendar kodira pirolizin, če je prisoten element PYLIS.
** UGA je običajno opalni (ali umber) stop kodon, vendar kodira selenocistein, če je prisoten element SECIS.
† Stop kodon ni aminokislina, vendar je vključen zaradi popolnosti.
†† UAG in UGA ne delujeta vedno kot stop kodona (glej zgoraj).
‡ Esencialne aminokisline se pri ljudeh ne more sintetizirati. Zagotoviti jo je treba s hrano. Pogojno esencialne aminokisline običajno niso potrebne v prehrani, vendar jih je treba zagotoviti populacijam, ki jih ne proizvedejo dovolj.
Tem α-aminokislinam, ki se pojavljajo v procesih biosinteze, so strukturno (tukaj z uporabo zapisa SMILES) povezane nebistvene kisline:
OC(=O)C(N)-
- ├ H .. V Glicin
- ├ C .. P Alanin
- │├ C .. 2-aminobutanojska kislina
- ││├ C .. Norvalin
- ││││├ -2H .. _ Prolin (dehidronorvalin)
- ││││├ C .. norleucin
- ││││└ N .. Z Lizin
- ││││ └ C(=O)C1N=CCC1C .. ^ Pirolizin
- ││││└ NC(=N)N .. a Arginin
- ││├ C(=O)N .. ` Glutamin
- │││├ C(=O)O .. T Glutaminska kislina
- │││├ O .. Homoserin
- │││└ S .. Homocistein
- ││ └ C .. \ Metionin
- │├ C(C)C .. [ Levcin
- │├ C(=O)N .. ] Asparagin
- │├ C(=O)O .. S Asparaginska kislina
- │├ C1=CNC=N1 .. W Histidin
- │├ c1ccccc1 .. U fenilalanin
- │├ c1ccc(O)cc1 .. h Tirozin
- │├ C1=CNc2ccccc12 .. f triptofan
- │├ C1=CNc2ccc(O)cc12 .. Oksitriptan
- │├ c(cc1I)cc(I)c1-O-c2cc(I)c(O)c(I)c2 ... Tiroksin
- │├ O .. b Serin
- │├ S .. R Cistein
- │└ [SeH] .. d Selenocistein
- ├ C(C)C .. e Valin
- ├ C(C)O .. c Treonin
- └ C(C)CC .. X Izolevcin
Vprašanja in odgovori
V: Kaj so aminokisline?
O: Aminokisline so molekule, ki imajo tako aminsko (NH2+R) kot karboksilno (C=O) funkcionalno skupino in so gradniki beljakovin.
V: Koliko "standardnih" aminokislin je v evkariontih?
O: V evkariontih je 20 "standardnih" aminokislin, iz katerih so sestavljene skoraj vse beljakovine.
V: Kakšna je splošna formula za alfa-aminokisline?
O: Splošna formula za alfa-aminokisline je H2NCHRCOOH, kjer je R ena od številnih stranskih skupin.
V: Na kaj se sklicuje biokemija, ko omenja aminokisline?
O: V biokemiji se izraz "aminokislina" nanaša na alfa-aminokisline s splošno formulo H2NCHRCOOH, kjer je R ena od številnih stranskih skupin.
V: Kako beljakovine dobijo svojo strukturo?
O: Beljakovine dobijo svojo strukturo iz kombinacije različnih vrst aminokislin.
V: Kakšno vlogo imata v molekuli aminokisline aminska in karboksilna funkcionalna skupina?
O: Aminske in karboksilne funkcionalne skupine sestavljajo molekulo aminokisline; zagotavljajo dušikov atom in ogljikov atom, ki lahko tvorita vezi z drugimi molekulami.
Iskati