Konrotatorni in disrotatorni: elektrociklične reakcije in Woodward-Hoffmann
Konrotatorni in disrotatorni: jasen vodič elektrocikličnih reakcij, Woodward–Hoffmann pravil, orbitalne simetrije in stereokemije v 4n/4n+2 π sistemih.
Elektrociklične reakcije so vrsta pericikličnih reakcij v organski kemiji, pri katerih se linearni konjugirani pi-sistemi zaprejo v obroč ali obroči odprejo v linearne sisteme. Pri teh reakcijah se končni pi-orbitali povežejo v novo sigma vez, pri čemer je ključna relativna smer vrtenja končnih orbital. Izraz konrotacijski (konrotatorni) opisuje način, ko se substituenti na obeh koncih konjugiranega sistema vrtita v isti smeri (ali oba "v smeri urinega kazalca", ali oba "proti njemu"). Nasprotno pa izraz disrotacijski (disrotatorni) opisuje način, ko se končni substituenti vrtita v nasprotnih smereh.
Kako izberemo način (konrotacijski ali disrotacijski)?
Odgovor dajejo Woodward–Hoffmannova pravila, ki temeljijo na ohranjanju simetrije porazdelitve elektronskih orbital med reakcijo. Najenostavneje:
- Toplotne (termalne) elektrociklične reakcije sledijo pravilom, kjer odločilno vlogo igra simetrija najvišje zasedene molekulske orbitale (HOMO). Za linearne konjugirane sisteme veljajo:
- Če sistem vsebuje 4n + 2 pi elektronov (n = 0, 1, 2, ...), je termalno dovoljeno disrotacijsko zapiranje.
- Če sistem vsebuje 4n pi elektronov, je termalno dovoljeno konrotacijsko zapiranje.
- Fotoinducirane (fotokemične) elektrociklične reakcije obratno upoštevajo pravila:
- Če sistem vsebuje 4n + 2 pi elektronov, je fotokemično dovoljeno konrotacijsko zapiranje.
- Če sistem vsebuje 4n pi elektronov, je fotokemično dovoljeno disrotacijsko zapiranje.
Zakaj pride do teh razlik?
Pri termalnih reakcijah se reakcija običajno dogaja preko ground-state konfiguracije elektronov — torej preko HOMO, katerega simetrija določi, kako lahko pi-orbitali koherentno prezaravnajo v novo sigma vez. Pri fotokemiji je sistem v vzbujenem stanju (elektron je promoviran v LUMO), zato se spremeni porazdelitev frontalnih orbital in s tem tudi pravilo dovoljene simetrije — izvorno "dovoljeno" gibanje se obrne.
Primeri in stereokemija
Tipičen primer termalne disrotacijske reakcije je zapiranje linearnega hexatriena (6 pi elektronov, torej 4n+2 z n=1) v cikloheksadien, kjer HOMO narekuje, da se končne p-orbitali obračata v nasprotni smeri, da se simetrija ujema in nastane pravilna simetrija nove sigma vezi. V izvirnem besedilu je naveden primer pretvorba trans-cis-trans-2,4,6-oktatriena v cis-dimetilcikloheksadien — tudi ta primer zahteva disrotacijski način zaradi porazdelitve HOMO.
Za 4-pi sisteme (npr. 1,3-butadien) termalno zapiranje poteka po konrotacijskem načinu; to vodi do drugačnega stereokemičnega izida kot disrotacija. Pri konrotaciji se oba konca zavrtita v isto smer, kar določa konfiguracijo substituentov v nastalem obroču (npr. ali sta substituenta cis ali trans). Zato so elektrociklične reakcije navadno stereospecifične – stereokemija produkta je odvisna od orientacije substituentov v začetnem polienskem sistemu in od načina vrtenja.
Povzetek in Woodward–Hoffmannova pravila
Woodward-Hoffmannova pravila povzema zgoraj navedene odnose med številom pi elektronov, načinom indukcije (toplotno ali foto) in dovoljenim načinom rotacije (konrotacijsko ali disrotacijsko). Ta pravila temeljijo na ohranjanju simetrije orbital med kontinuiranim prehodom od reaktanta do produkta in so temeljni koncept pri razumevanju pericikličnih procesov v organski kemiji.

Če želite praktično napovedati, kateri način bo dovoljen za določen konjugirani sistem, preštejte pi elektrone, določite, ali je reakcija termalna ali fotokemična, in uporabite zgornja pravila. Za globlje razumevanje je koristno tudi risanje HOMO (ali ustreznega vzbujenega stanja) ter preverjanje simetrije frontalnih orbital.
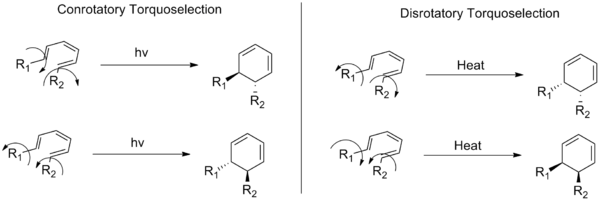
Konrotatorni in disrotatorni način rotacije, ki prikazujeta dve možni smeri rotacije, ki privedeta do para enantiomerov za splošni heksatrienski sistem.
Vprašanja in odgovori
V: Kaj je elektrociklična reakcija?
O: Elektrociklična reakcija je vrsta organske kemijske reakcije, pri kateri se sistem konjugiranih dvojnih vezi odpre ali zapre in tvori obroč.
V: Kakšna je razlika med konrotatornimi in disrotatornimi načini?
O: Pri konrotacijskem načinu se substituenti, ki se nahajajo na koncih konjugiranega sistema dvojne vezi, med odpiranjem ali zapiranjem obroča gibljejo v isti smeri (v smeri urinega kazalca ali proti njemu). Nasprotno pa se pri disrotacijskem načinu gibljejo v nasprotnih smereh.
V: Kako orbitalna simetrija vpliva na te reakcije?
O: Pri določanju, ali reakcija poteka po konrotacijskih ali disrotacijskih pravilih, je treba upoštevati orbitalno mehaniko reakcije. Na primer, sistemi, ki vsebujejo 4n + 2 pi elektrona, so stereospecifični in sledijo konrotacijskemu pravilu zaradi ohranjanja orbitalne simetrije v najvišje zasedenih molekulskih orbitalah (HOMO). Sistemi, ki vsebujejo 4n pi elektronov, imajo nasprotno disrotacijsko pravilo. To velja tudi za preureditve 4n + 2 pi (kjer je n celo število) elektronov, ki jih poganja svetloba (fotoinducirane). Fotoinducirane preureditve sistemov s 4n pi elektroni (kjer je število elektronov deljivo s 4) sledijo disrotacijskemu pravilu.
V: Kaj so Woodward-Hoffmannova pravila?
O: Woodward-Hoffmannova pravila povzemajo različne vrste elektrocikličnih reakcij in kako nanje vplivajo dejavniki, kot sta orbitalna simetrija in prisotnost/odsotnost svetlobne energije.
V: Kaj prikazuje ta slika?
O: Slika prikazuje primer pretvorbe iz trans-cis-trans-2,4,6-oktatriena v cis-dimetilcikloheksadien in ponazarja, kako se substituenti gibljejo različno glede na to, ali gre za konorotarni ali disrorotarni način - v smeri urinega kazalca oziroma proti njemu, če gledamo od zgoraj.
Iskati