Enol: definicija, tautomeri, enolati in vloga v organski kemiji
Enoli, enolati in tautomeri: jasna razlaga priprave, kinetičnih/termodinamičnih enolatov ter ključnih reakcij (npr. aldolna) v organski kemiji.
Enol je alken, ki ima na enem koncu dvojne vezi priključeno hidroksilno skupino (–OH). Strukturno ga lahko zapišemo kot R–C(OH)=C–R′. Če je pri tem proton na kisikovem atomu odstranjen, nastane njegov anion, imenovan enolat (R–C(O–)=C–R′). Enolati so torej konjugirani anioni, stabilizirani z rezonanco med kisikom in ogljikom.
Tautomerija: enol in keto oblika
Enoli so tavtomeri ketonov ali aldehidov. Tautomeri so molekule, ki se razlikujejo le po položaju vodikovega atoma in premiku vezi (običajno proton in dvojna vez). Pri običajnih enol–keto sistemih prevladuje keto oblika, ker je vez C=O energijsko močnejša in stabilnejša od C=C–OH kombinacije. Vendar obstajajo pomembne izjeme: če je enol stabiliziran z vodikovo vezjo ali z dodatno konjugacijo (npr. pri β‑diketonih ali fenolskih sistemih), lahko enolna oblika v ravnotežju prevladuje.
Priprava enolatov in pogoji
Enole iz ketonov ali aldehidov lahko pripravimo z uporabo baze, ki odstrani α‑proton. Ker je pKa tipičnega α‑protona ketona približno ~20 (odvisno od substituentov), so za sproščeno tvorbo enolatov potrebne močne baze. Pogosti postopki vključujejo:
- uporabo močnih, sterično zaviralnih baz (npr. litijev diizopropilamid, LDA) pri nizkih temperaturah (npr. −78 °C) za hitro in selektivno tvorbo kinetičnega enolata;
- uporabo šibkejših baz (alkoksidi) ali povišana temperatura za dosego ravnotežja in tvorbo stabilnejšega termodinamičnega enolata;
- alternativno tvorbo preko enaminov (reakcija sekundarnih aminov s ketoni/aldehidi) kot mehansko mehanska pot do alkilacij/aldolnih tipov reakcij;
- pretvorbo enolatov v zaščitene oblike, npr. silyl‑enoleterje (silyl enol ethers), ki jih dobimo z uporabo silyl‑halogenidov in baze — to omogoča lažje in selektivnejše nadaljnje reakcije.
Kinetični in termodinamični enolat
Pri ketonih, ki imajo na obeh straneh α‑protoni, lahko nastaneta dve različni enolni (enolatski) obliki. Pomembno je, da izberemo, na kateri strani bomo reagirali:
- Kinetični enolat nastane pri hitro odstranjenem, bolj dostopnem (manj substituiranem) α‑protonu. Daje se ga doseči z močnimi in sterično zaviralnimi bazami pri nizkih temperaturah — ta pot je hitrejša in daje produkt, ki ni nujno najstabilnejši.
- Termodinamični enolat je bolj stabilen (pogosto iz bolj substituirane strani) in nastane, če omogočimo dosego ravnotežja (šibkejše baze, višja temperatura ali daljši čas). Ta enolat ima nižjo prostorsko in energijsko energijo.
Reaktivnost in vloga v organski kemiji
Enoli in enolati so izjemno pomembni reaktanti v organski sintezi, predvsem kot nukleofili na α‑ogljiku. Njihova značilna reaktivnost vključuje:
- Aldolna reakcija — združevanje dveh karbonilnih spojin preko enolata (ali enamina) vodi do β‑hidroksiketona/aldehida, ključni korak v številnih sintezah;
- Claisenova kondenzacija, Michaelove adicije, Robinsonova anelacija in druge karbonilne konstrukcije — vse temeljijo na nucleofilnosti enolatov;
- α‑halogenacija in druge elektrofilske substitucije na α‑ogljiku preko medija enola ali preko enolatov;
- enolati so ambidentni nukleofili — lahko reagirajo bodisi preko kisika (O‑alkilacija/akiloacilacija) bodisi preko ogljika (C‑alkilacija). Izid je odvisen od tipa elektrofila, kovinskega kationa, topila in pogojev reakcije.
O‑ vs C‑selektivnost in vpliv kovinskega kationa
Enolat je ambidenten: nukleofilnost je razporejena med kisik in α‑ogljik. Splošne usmernice:
- reakcije z mehkejšimi elektrofili (npr. alkilhalidi) pogosto dajejo C‑alkilacijo (želena obliko za gradnjo C–C vezi);
- reakcije, kjer kovinski kation močno koordinira kisik (npr. litijevi enolati), lahko povečajo elektronsko gostoto na ogljiku in spremenijo selektivnost;
- velikost in narava kovinskega kationa (Li+, Na+, K+) ter agregacijsko stanje (dimerni, tetramerni kompleksi) vplivata na reaktivnost in selektivnost enolatov;
- topilo, temperatura in prisotnost ligantov (npr. HMPA) lahko drastično spremenijo potek reakcije.
Stabilnost enolov in primeri stabilizacije
Čeprav so enoli pogosto manj stabilni od keto oblik, obstajajo mehanizmi stabilizacije:
- konjugacija z drugimi π‑sistemi (npr. aromatični obroč ali drugi karbonili) močno stabilizira enolno obliko;
- intramolekularne vodikove vezi (npr. pri β‑diketonih) stabilizirajo enol in lahko celo prevesijo ravnotežje v prid enolu;
- kovinska koordinacija kisika (pri enolatih) zakrivi razporeditev naboja in vpliva na reaktivnost.
Spektroskopske značilnosti
Enoli običajno pokažejo karakteristične absorpcije v IR spektru (širok O–H razteg okoli 3200–3600 cm−1, absorpcija C=C) ter posebne kemijske premike v 1H‑NMR (O–H signal in alkenskih protonov). Enolati kot anioni nimajo O–H signala in kažejo spremembe v 13C in 1H NMR, odvisno od koordinacije kovinskega kationa.
Skupaj so enoli in njihovi enolati temelj mnogih organskokemijskih sinteznih strategij. Čeprav je keto oblika pogosto termodinamično ugodnejša, omogoča kontrolirana tvorba enolatov natančno izdelavo C–C vezi in drugih transformacij, kar je osrednjega pomena pri gradnji kompleksnih molekul in naravnih produktov.
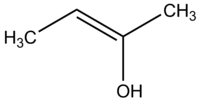
Enol
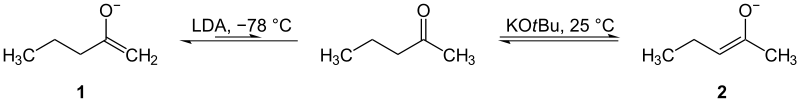
Kinetični (1) in termodinamični (2) enolati
Vprašanja in odgovori
V: Kaj je enolončnica?
O: Enol je alken, ki ima na enem koncu dvojne vezi priključeno OH-skupino.
V: Kaj je enolat?
O: Enolat je enol z odstranjenim protonom na kisikovem atomu.
V: Kaj so tavtomeri?
O: Tautomeri so molekule, ki se razlikujejo le po položaju vodikovega atoma.
V: Kako lahko iz ketonov ali aldehidov dobimo enole?
O: Enole lahko zlahka naredimo iz ketonov ali aldehidov z uporabo baze.
V: Zakaj so enoli nestabilni?
O: Enoli so nestabilni, ker je vez C=O močnejša od vezi C=C.
V: Kaj je aldolna reakcija?
O: Aldolna reakcija je zanimiva reakcija, ki jo lahko izvedemo z enoli.
V: Kako lahko stran enola z manj substituenti pripravimo za reakcijo?
O: Stran enola z manj substituenti, ki se imenuje kinetični enolat, lahko pri nizki temperaturi pripravimo z obsežno bazo za reakcijo.
Iskati