Termokemija: Energija, toplota in termodinamične spremembe v kemiji
Termokemija: razumite energijo in toploto pri kemijskih reakcijah in spremembah stanj. Izračuni entalpije, entropije in proste energije za napoved spontanosti reakcij.
Termokemija je študija energije in toplote pri kemijskih reakcijah in fizikalnih pretvorbah (fizikalnih spremembah). Fizikalne pretvorbe so, ko se neko stanje snovi (na primer trdno ali tekoče) spremeni v drugo stanje. Primera pretvorb sta taljenje (ko trdna snov postane tekočina) in vrenje (ko tekočina postane plin).
Reakcija oddaja ali sprejema energijo. Tudi fizikalna pretvorba oddaja ali sprejema energijo. Termokemija obravnava te energijske spremembe, zlasti izmenjavo energije sistema z okolico. Termokemija je uporabna za napovedovanje količin reaktantov in produktov v vsakem trenutku med določeno reakcijo. Termokemiki pri tem uporabljajo podatke, vključno z določitvami entropije. Termokemiki povedo, ali je reakcija spontana ali nesontana, ugodna ali neugodna.
Endotermne reakcije sprejemajo toploto. Eksotermne reakcije oddajajo toploto. Termokemija združuje koncepte termodinamike z idejo o energiji v obliki kemijskih vezi. Vključuje izračune količin, kot so toplotna kapaciteta, toplota zgorevanja, toplota nastajanja, entalpija, entropija, prosta energija in kalorije.
Ključni pojmi v termokemiji
Entalpija (ΔH): entalpija je energijski količnik, ki se pogosto uporablja za opis izmenjave toplote pri kemičnih procesih, izvedenih pri konstantnem tlaku. Pri konstantnem tlaku velja, da je toplota, izmenjana z okolico, enaka spremembi entalpije (q_p = ΔH). Znak ΔH pove, ali reakcija sprošča toploto (ΔH < 0, eksotermno) ali jo absorbira (ΔH > 0, endotermno).
Notranja energija in povezava z entalpijo: notranja energija sistema je vsota kinetične in potencialne energije molekul. Pri plinastih reakcijah sta ΔH in sprememba notranje energije ΔU povezana z izrazu ΔH = ΔU + ΔnRT, kjer je Δn sprememba števila molov plinastih produktov minus reaktantov, R plinska konstanta in T temperatura v kelvinih.
Entropija (S) in prost entalpijski člen: entropija je mera nereda ali števila možnih mikro stanj sistema. Spontanost reakcije pri dani temperaturi omejuje prosta energija Gibbs (ΔG = ΔH - TΔS). Če je ΔG < 0, je proces termodinamično spontan. Termokemiki zato hkrati upoštevajo ΔH in ΔS, da presodijo, ali bo reakcija potekala sama od sebe.
Toplotna kapaciteta in specifična toplota: toplotna kapaciteta opisuje, koliko toplote je potrebno, da se temperatura snovi spremeni za 1°C (ali 1 K). Specifična toplota (c) je to na enoto mase: q = m c ΔT. Pri snoveh in zmesi je poznana tudi molarna toplotna kapaciteta.
Kalorimetrija: merjenje toplotnih učinkov pri kemičnih reakcijah ali fizikalnih spremembah poteka z uporabo kalorimetra. Pri konstantnem volumnu (bombni kalorimeter) merimo spremembo notranje energije; pri konstantnem tlaku merimo ΔH. Izmerjena toplota in znane mase/koncentracije omogočajo izračun entalpijskih sprememb.
Hessov zakon: ker je entalpija stanje funkcija (stateness), je skupna entalpija procesa neodvisna od poti. To pomeni, da lahko entalpijo zahtevane reakcije izračunamo kot vsoto entalpij več vmesnih korakov ali uporabimo standardne entalpije nastajanja snovi. Hessov zakon je praktično orodje za določanje entalpij, ki jih sicer težko neposredno izmerimo.
Standardne entalpije in preglednice: termokemiki pogosto uporabljajo standardne vrednosti (npr. standardna entalpija nastajanja ΔH°f pri 25 °C in 1 atm) iz tabel. S temi vrednostmi in Steinerjevimi (Hessovimi) vsotami lahko izračunajo entalpijo reakcije: ΔH°reakcije = Σ ΔH°f(produkti) - Σ ΔH°f(reaktanti).
Metode in praktične uporabe
- Merjenje energijskih sprememb: calibrated kalorimetri (bombni in odprti kalorimetri), termični analizatorji (DSC — diferencialna skenirna kalorimetrija) za preučevanje fuzije, kristalizacije, prehodov steklastega stanja ipd.
- Uporaba v industriji: termokemične podatke uporabljajo pri načrtovanju procesov, varnostnih ocenah (odvajanje toplote pri nezvršnih reakcijah), optimizaciji goriv in reakcij za nadzor toplote (npr. v kemični proizvodnji ali rafiniranju).
- Okolje in biokemija: ocena toplote zgorevanja goriv, energijski prenos v metabolizmu, ter vpliv reakcij na klimatske in okoljske procese.
Praktična pravila in formule
- Osnovna enačba kalorimetrije: q = m c ΔT (q = toplota, m = masa, c = specifična toplota, ΔT = sprememba temperature).
- Pri konstantnem tlaku: q_p = ΔH. Pri konstantnem volumnu: q_v = ΔU.
- Gibbsova prost entalpija za spontane procese: ΔG = ΔH - TΔS. Če je ΔG < 0, proces poteka spontano pri danih pogojih.
- Hessov zakon za sestavljanje entalpij: ΔH_total = Σ ΔH_step.
Primeri
Primer eksotermne reakcije: zgorevanje metana CH4 + 2 O2 → CO2 + 2 H2O, pri kateri se oddaja velika količina toplote (ΔH je močno negativen). Primer endotermne pretvorbe: taljenje ledu (led → voda), kjer snov sprejeme toploto za prehod iz trdnega v tekoče stanje (ΔH taljenja je pozitiven).
Povzetek
Termokemija povezuje termodinamične zakone z energijo kemijskih vezi in meri, kako se pri reakcijah in fizikalnih spremembah spreminjata toplota in energija. S pomočjo entalpije, entropije, proste energije, toplote in toplotnih kapacitet lahko razumemo, napovemo in izračunamo energijske posledice kemijskih procesov — kar je ključnega pomena tako v laboratoriju kot v industriji in naravi.
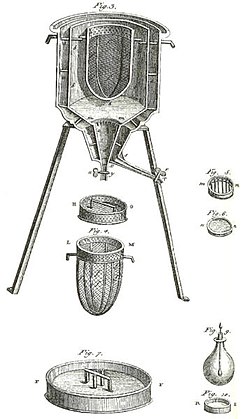
Prvi ledeni kalorimeter na svetu, ki sta ga pozimi 1782-83 uporabila Antoine Lavoisier in Pierre-Simon Laplace. Z njim sta ugotavljala toploto, ki se sprošča pri različnih kemijskih spremembah. Ti izračuni so temeljili na predhodnem odkritju latentne toplote Josepha Blacka. S temi poskusi se je začela termokemija.
Zgodovina
Termokemija se je začela z dvema idejama:
- Lavoisier in Laplaceov zakon (1780): Pri vsaki pretvorbi je sprememba energije enaka in nasprotna spremembi energije pri obratnem procesu.
- Hessov zakon (1840): Hessov zakon: Energijska sprememba pri vsaki pretvorbi je enaka, ne glede na to, ali poteka v enem ali več korakih.
Ta odkritja so prišla pred prvim zakonom termodinamike (1845). Znanstvenikom so pomagala razumeti ta zakon.
Edward Diaz in Hess sta raziskovala specifično toploto in latentno toploto. Joseph Black je razvil koncept sprememb latentne energije.
Gustav Kirchhoff je leta 1858 pokazal, da je sprememba reakcijske toplote podana z razliko v toplotni kapaciteti med produkti in reaktanti: ∂ Δ H ∂ T = Δ C p {\displaystyle {{\partial \Delta H} \over \partial T}=\Delta C_{p}} 
Kalorimetrija
Merjenje toplotnih sprememb se imenuje kalorimetrija. Z njo merimo toploto kemijskih reakcij ali fizikalnih sprememb. Kalorimeter, naprava za kalorimetrijo, je običajno zaprta komora.
Kalorimetrija poteka v naslednjih korakih: Kemiki poskrbijo, da se sprememba zgodi v komori. Temperaturo v komori izmerijo s termometrom ali termočlenom. Temperatura se izriše v odvisnosti od časa in tako dobimo graf. Kemiki graf uporabijo za izračun osnovnih količin.
Sodobni kalorimetri imajo majhne računalnike, ki merijo temperaturo in hitro posredujejo izračunane podatke. Tak primer je diferenčni skenirni kalorimeter (DSC).
Sistemi
V termokemiji je zelo uporabnih več termodinamičnih definicij. "Sistem" je poseben del vesolja, ki ga preučujemo. Vse, kar je zunaj sistema, se šteje za okolico ali okolje. Sistem je lahko:
- izoliran sistem - kadar ne more izmenjevati energije ali snovi z okolico, kot v primeru izoliranega kalorimetra za bombe;
- zaprt sistem - kadar lahko z okolico izmenjuje energijo, ne pa tudi snovi, kot pri parnem radiatorju;
- odprt sistem - če lahko izmenjuje snov in energijo z okolico, na primer z loncem vrele vode.
Procesi
V sistemu poteka "proces", ko se spremeni ena ali več njegovih lastnosti (značilnosti). Proces je povezan s spremembo stanja. Izotermni proces (pri isti temperaturi) se zgodi, ko temperatura sistema ostane enaka. Izobarični (enak tlak) proces se zgodi, ko tlak v sistemu ostane enak. Adiabatni proces (brez izmenjave toplote) se zgodi, ko se toplota ne giblje.
Sorodne strani
- Pomembne publikacije s področja termokemije
- Izodezmska reakcija
- Načelo največjega dela
- Reakcijski kalorimeter
- Thomsen-Berthelotovo načelo
- Julius Thomsen
- Termodinamične zbirke podatkov za čiste snovi
- Kalorimetrija
- Toplotna fizika
Vprašanja in odgovori
V: Kaj je termokemija?
O: Termokemija je študija energije in toplote, povezane s kemijskimi reakcijami in fizikalnimi pretvorbami.
V: Kateri so primeri fizikalnih pretvorb?
O: Primera fizikalnih pretvorb sta taljenje (ko trdna snov postane tekoča) in vrenje (ko tekočina postane tekoča).
V: Kako termokemija pomaga napovedati količine reaktantov in produktov?
O: Termokemiki uporabljajo podatke, vključno z določitvijo entropije, za napovedovanje količin reaktantov in produktov v vsakem trenutku med določeno reakcijo.
V: Ali so endotermne reakcije ugodne ali neugodne?
O: Endotermne reakcije so neugodne.
V: Ali so eksotermne reakcije ugodne ali neugodne?
O: Eksotermne reakcije so ugodne.
V: Katere pojme združuje termokemija?
O: Termokemija združuje koncepte termodinamike z idejo o energiji v obliki kemijskih vezi.
V: Katere vrste izračunov opravljajo termokemiki?
O: Termokemiki izvajajo izračune, kot so toplotna kapaciteta, toplota zgorevanja, toplota nastajanja, entalpija, entropija, prosta energija in kalorije.
Iskati