Prehodno stanje (‡) v kemiji: definicija, aktivacijska energija in pomen
Prehodno stanje (‡) v kemiji: razlaga, aktivacijska energija, pomen za reakcijske mehanizme in metode preučevanja — jasen vodnik za študente in raziskovalce.
Pri kemijski reakciji je prehodno stanje točka na energetskem profilu, v kateri ima sistem največjo energijo. To energijsko oviro imenujemo aktivacijska energija. Ko se dve ali več molekul pomeša in trčita druga v drugo, lahko ob trku z dovolj energije prečkata prehodno stanje ‡ in nadaljujeta do tvorbe novih molekul. V prehodnem stanju se postopoma tvorijo nove vezi, medtem ko se stare vezi pretrgajo; torej gre za trenutek, ko je sistem hkrati deloma razpokan in deloma povezan na nov način. Na grafikonu energijskega profila je prehodno stanje pogosto označeno s simbolom ‡.
Kaj prehodno stanje ni
Pogosto pride do zmede med prehodnim stanjem in vmesnimi stanji. Pomembna razlika je v tem, da so vmesna stanja (intermediat) energijski minimumi na potencialni energetski površini in imajo relativno daljšo življenjsko dobo; lahko jih v nekaterih primerih celo izoliramo ali zaznamo. Prehodno stanje pa je saddle point (prvi red) na potencialni energetski površini — torej energijski maksimum po smeri reakcijskega koordinata — in ga ne moremo neposredno izolirati.
Zakaj je prehodno stanje težko opazovati
Prehodno stanje je zelo kratkotrajno; molekule v njem običajno ostanejo le nekaj femtosekund. Zaradi te extreme kratkosti in visoke energije ga neposredne eksperimentalne tehnike težko zajamejo. Zato ga pogosto preučujemo posredno — preko meritev hitrosti reakcije, kinetičnih izotopskih efektov, spektroskopije na zelo kratkih časovnih odsekih ali zračunskih metod v kvantni kemiji.
Preučevanje prehodnih stanj in teoretični okvir
Razumevanje prehodnih stanj je temeljno za razlago reakcijskih mehanizmov. Glavni teoretični okvir je teorija prehodnega stanja (Transition State Theory, TST), ki povezuje višino energijske ovire z verjetnostjo prehoda in s hitrostjo reakcije — del tega področja obravnava tudi kemijsko kinetiko. Izračuni prehodnih stanj običajno vključujejo iskanje prvega rednega saddle pointa na potencialni energetski površini, določitev ene imaginarne vibracijske frekvence (ki ustreza gibanju po reakcijskem koordinatu) in sledenje intrinsični reakcijski poti (IRC), da se potrdi, da ta saddle point povezuje želene reaktante in produkte.
Računalniške in eksperimentalne metode
- Računalniške metode: kvantno-kemijske metode (npr. DFT, ab initio) se uporabljajo za optimizacijo prehodnih stanj, določitev energij, geometrij in vibracijskih frekvenc ter za sledenje IRC poti. Rezultat pogosto pokaže geometrijo, kjer so vezi delno oblikovane/razbite, in prisotnost ene imaginarne frekvence.
- Eksperimentalne metode: ultrahitri spektroskopski poskusi (femtosekundna spektroskopija), merjenja hitrosti reakcije in kinetični izotopski efekti dajo vpogled v značilnosti prehodnega stanja. Prav tako kataliza in študije temperaturne odvisnosti hitrosti (npr. Eyringova analiza) pomagajo razločiti enthalpijsko in entropijsko sestavino aktivacijske ovire.
Pomen v praksi
Razumevanje prehodnih stanj je ključno za:
- razlago in napovedovanje hitrosti kemijskih reakcij;
- načrtovanje katalizatorjev, ki znižajo aktivacijsko energijo in tako pospešijo reakcijo;
- napovedovanje stereo- in regioselektivnosti (npr. zakaj potekajo SN2 reakcije preko določene geometrije prehodnega stanja);
- razumevanje kvantnega tuneliranja v reakcijah, kjer delci prehajajo energijsko oviro brez dosega klasične aktivacijske energije.
Dodatne značilnosti
Prehodno stanje je matematično opisano kot prvi red saddle point na potencialni energetski površini: to pomeni, da je energija maksimum vzdolž reakcijskega koordinata, ampak minimum v preostalih smerih. Za potrditev TS v računalniških izračunih iščemo eno imaginarno vibracijsko frekvenco, katerih pripadajoči način oslikava zamik reagenta proti produkta. Prav tako velja Hammondov postul — pri endergonskih reakcijah je prehodno stanje bolj podobno produktom, pri eksergonskih pa bolj podobno reaktantom — kar pomaga predvidevati geometrijo in lastnosti TS.
Na kratko: prehodno stanje ‡ je ključni, a kratkotrajni vrh na poti reakcije, ki določa energijsko oviro in s tem hitrost ter potek kemične reakcije. Čeprav ga ne moremo izolirati, ga kombinacija eksperimentalnih opazovanj in računalniških metod naredi razumljivega in uporabnega za kemike pri oblikovanju reakcij in katalizatorjev.
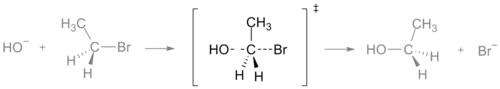
Prehodno stanje reakcije SN2
Vprašanja in odgovori
V: Kaj je prehodno stanje v kemijski reakciji?
O: Prehodno stanje je točka, kjer je pri kemijski reakciji največja vrednost energije.
V: Kaj je aktivacijska energija pri kemijski reakciji?
O: Energija, ki je potrebna, da reakcija steče, se imenuje aktivacijska energija.
V: Kaj se zgodi, ko se v kemijski reakciji zmešata dve ali več molekul?
O: Ko se dve ali več molekul pomešata, trčita druga v drugo. Če zadenejo z dovolj energije, da preidejo skozi prehodno stanje, bodo reagirale in tvorile nove molekule.
V: Za kaj se na grafu ali risbi kemijske reakcije uporablja simbol dvojne puščice (‡)?
O: Simbol dvojne šibe (‡) se uporablja za označevanje prehodnega stanja na grafu ali risbi kemijske reakcije.
V: Zakaj je težko preučiti prehodno stanje pri kemijski reakciji?
O: Prehodno stanje v kemijski reakciji je zelo težko preučevati, ker ima tako visoko energijo, da molekule ostanejo v tej obliki zelo kratek čas, običajno femtosekunde.
V: Kaj je vmesni produkt pri kemijski reakciji?
O: Vmesni produkt je molekula, ki se nahaja na minimalnih energijskih točkah v kemijski reakciji in lahko živi zelo dolgo.
V: Zakaj je preučevanje prehodnih stanj pomembno za razumevanje reakcijskih mehanizmov?
O: Preučevanje prehodnih stanj je pomembno za razumevanje reakcijskih mehanizmov, ker pomaga določiti, kako reakcija poteka in kako jo nadzorovati ali manipulirati.
Iskati