Reakcijski mehanizem: definicija, tipi in primeri v organski kemiji
Reakcijski mehanizem: definicija, tipi in primeri v organski kemiji — jasna razlaga korakov, intermediati, prehodna stanja ter nukleofilna substitucija, eliminacija in adicija.
Reakcijski mehanizem je zapis, kako kemijska reakcija poteka korak za korakom. Običajno je pri reakciji vidna le splošna sprememba. Vmesne snovi reagirajo prehitro, da bi jih bilo mogoče opaziti. Imenujemo jih intermediati, pri prehodu iz enega intermediata v drugega pa se preide prehodno stanje. Vendar je pomembno razumeti vse korake, ki povzročijo celotno spremembo. Tako lahko namreč razumemo težje reakcije ali poskušamo reakcijo izpeljati na določen način.
Obstaja veliko vrst reakcijskih mehanizmov. V organski kemiji so najpogostejši nukleofilna substitucija, eliminacija in adicija. Ljudje včasih uporabljajo potiskanje puščic, da narišejo, kako se elektroni premikajo med reakcijo. Tako je lažje videti, katere vezi med procesom nastanejo in katere se prekinejo.
Tipi reakcijskih mehanizmov in primeri
- Nukleofilna substitucija
- SN2 – poteka v enem koraku (koncertno). Primer: CH3Br + OH− → CH3OH + Br−. Značilno je inverzno stereokemijsko preurejanje (Waldenova inverzija) in odvisnost hitrosti reakcije od koncentracije substrata in nukleofila.
- SN1 – poteka po dveh korakih: najprej odhod skupine, nastane karbokation, nato napad nukleofila. Primer: reakcija terciarnega alkil-halogenida v polarnih protic solventih. Pogosta je racemizacija in možnost preureditev karbokationa.
- Eliminacija
- E2 – concerted odstranitev protona in odhod ostanka v enem koraku; zahteva anti‑periplanarno poravnavo v primeru alifatnih spojin. Tipičen primer: dehidrohalogenacija alkil-halogenidov z močno bazo, vodi do nastanka alkena (Zaitsevovo pravilo).
- E1 – poteka preko karbokationa, podobno kot SN1, zato so možni prehodi in preureditve.
- Adicija
- Elektrofilna adicija na alken: npr. addition Br2 na dvopoiščno vez preko bromonijevega iona; ali HBr na alken (Markovnikov ali anti‑Markovnikov pod vplivom peroksidov).
- Radikalna adicija: verižni procesi, npr. hidrohalogeniranje pod radikalnimi pogoji.
- Radikalni mehanizmi – potekajo preko prostih radikalov (single‑electron procesi). Primer: kloriranje metana s svetlobo (hv) – iniciacija, propagacija (CH3• + Cl2 → CH3Cl + Cl•) in terminacija.
- Periciklične reakcije – concerted procesi, kjer se vezi tvorijo in pretrgajo v enem prehodu (npr. Diels–Alderjeva reakcija: cikloadicija diene in dienofila za tvorbo cikličnih produktov).
Značilnosti mehanizmov in terminologija
Intermediat je stabilen ali pol‑stabilen vmesni produkt (npr. karbokation, radikal, karbanion). Prehodno stanje (transition state) je energijska maksimumna točka na reakcijski koordinatni krivulji in je neopazno, a odločilno za hitrost reakcije. Po Hammondovem postulatu naj bi struktura prehodnega stanja spominjala na tisto izmed reaktantov ali produktov, ki je bližje po energiji, kar pomaga razložiti stereokemijo in hitrosti.
Puščice in pravila za risanje mehanizmov: pri organski kemiji uporabljamo zavite (curly) puščice za premik pare elektronov (dvosmerne vezi ali lone pair → vez), za radikale pa enojne puščice (single‑barbed arrows) kažejo premik enega elektrona. Pomembno je upoštevati ohranjanje naboja in števila elektronov v posameznih korakih.
Energetski diagram in kinetika
Diagram energije glede na reakcijsko koordinato prikaže energijsko bariero (aktivacijska energija, Ea) in razliko prostih energij med reaktanti in produkti (ΔG). Večji kot je Ea, počasnejša je reakcija pri dani temperaturi; vpliv temperature opisuje Arrheniusova enačba. Hitrostna zakonitost (npr. prvo‑, drugo‑ordna kinetika) in odvisnost hitrosti od koncentracij obeh reagentov pomagata ločiti mehanizme (npr. SN1 vs SN2).
Kako preučujemo mehanizme
- Hitrostne študije in določitev redov reakcije
- Izotopsko označevanje (npr. deuterij), kinetic isotope effects za identifikacijo prehodnih stanj
- Spektroskopske metode: NMR, IR, UV‑Vis, masna spektrometrija za zaznavanje intermediatov ali produktov
- Ujetje intermediatov s ''trapping'' reagenti
- Računalniške metode (DFT, ab initio) za optimizacijo geometrij prehodnih stanj in izračun energij
Praktični pomen in aplikacije
Razumevanje reakcijskega mehanizma je ključno za načrtovanje sintez in za optimizacijo pogojev (izbira topila, temperature, katalizatorja, baze ali kisline). Poznavanje mehanizma omogoča preprečevanje nezaželenih stranskih reakcij, izkoriščanje stereokemije produktov, ter razvoj selektivnih in ''green'' postopkov.
Nasveti za študij mehanizmov
- Vadi risanje mehanizmov s puščicami in preverjaj ohranjanje nabojev.
- Ugotovi limitirajoči korak na osnovi hitrosti in energije.
- Spomni se značilnosti reagentov: jakost nukleofila, stabilnost karbokationa, polarizabilnost ostanka, narava topila.
- Preuči stereokemijske posledice (inverzija, racemizacija, anti‑periplanarni zahtevki).
Z razumevanjem mehanizmov postane organska kemija manj arbitrarna in bolj predvidljiva; znanje omogoča načrtovanje bolj učinkovitih, varnih in selektivnih reakcijskih poti.
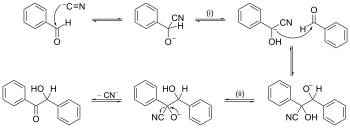
Primer reakcijskega mehanizma s potiskanjem puščice
Vprašanja in odgovori
V: Kaj je reakcijski mehanizem?
O: Reakcijski mehanizem je postopna razlaga poteka kemijske reakcije.
V: Zakaj je pomembno razumeti vse korake v reakcijskem mehanizmu?
O: Pomembno je razumeti vse korake v reakcijskem mehanizmu, če želimo razumeti težavne reakcije ali poskusiti, da bi reakcija potekala na določen način.
V: Kaj so vmesni produkti pri kemijski reakciji?
O: Vmesni produkti so snovi, ki nastanejo med reakcijami, ki reagirajo prehitro, da bi jih bilo mogoče opaziti pri kemijski reakciji.
V: Kaj je prehodno stanje v kemijski reakciji?
O: Prehodno stanje je prehod iz enega vmesnega produkta v drugega med kemijsko reakcijo.
V: Katere so najpogostejše vrste reakcijskih mehanizmov v organski kemiji?
O: Najpogostejši reakcijski mehanizmi v organski kemiji so nukleofilna substitucija, eliminacija in adicija.
V: Kaj je potiskanje puščice v mehanizmu kemijske reakcije?
O: Včasih se za prikaz premikanja elektronov med reakcijo uporablja premikanje puščic. Tako je lažje videti, katere vezi med procesom nastanejo in katere se prekinejo.
V: Katere informacije lahko pridobimo z razumevanjem reakcijskega mehanizma?
O: Z razumevanjem reakcijskega mehanizma lahko pridobimo informacije o tem, kako doseči, da bo reakcija potekala tako, kot si želimo, ali kako razumeti težje reakcije.
Iskati