Eliminacijska reakcija: definicija, mehanizmi E1 in E2 ter primeri
Eliminacijska reakcija – jasna definicija, primerjava mehanizmov E1 in E2 ter primeri (alkoholi, odhajajoče skupine) v organski kemiji.
V organski kemiji je reakcija eliminacije reakcija, pri kateri se iz večje molekule odvzamejo nekateri atomi ali skupina atomov. Običajno se s to reakcijo ustvari dvojna ali trojna vez. Eliminacijske reakcije so temeljni način za sintezo alkenov in alkinov ter igrajo pomembno vlogo pri preoblikovanju funkcionalnih skupin v organski sintezi.
Osnovni pojmi in pogoji
Za potek eliminacije so pomembni trije elementi:
- substrat (običajno alkilhalid ali protonirana/alilna oblika alkohola),
- odhajajoča skupina (npr. halogen, voda),
- baza (lahko močna ali šibka, nevtralna ali negativno nabita).
Pri izbiri pogojev reakcije je treba upoštevati tudi konkurenčne poti, predvsem nukleofilno substitucijo (SN1, SN2). Višja temperatura običajno spodbuja eliminacijo pred substitucijo.
Mehanizem E1
E1 (eliminacija unimolekularna) poteka v dveh korakih:
- Odstop odhajajoče skupine izvedi spontano in tvori karbokation (ta korak je določilen s hitrostjo reakcije).
- Baza odvzame β‑proton iz karbokacija ali iz susednega atoma ogljika, kar vodi v nastanek dvojne vezi.
Lastnosti E1:
- Kinetika: hitrost je odvisna samo od koncentracije substrata (rate = k[substrat]).
- Substrati: terciarni > sekundarni > primarni (zaradi stabilnosti karbokatiov).
- Solvent: polarni protici (npr. alkoholi, voda) stabilizirajo karbokation in pospešijo E1.
- Rearanžmaji: ker nastane karbokation, so pogosti hidridni ali alkilni premiki, ki lahko spremenijo končni produkt.
Primer: dehidracija alkoholov v kislem okolju — če je v bližini močna kislina, se lahko izloči molekula vode, ki tvori dvojno vez (to je klasičen primer E1 pri sekundarnih in terciarnih alkoholih).
Mehanizem E2
E2 (eliminacija bimolekularna) je enostopenjski, koncertiran potek, kjer baza hkrati odvzame β‑proton in odhajajoča skupina zapusti molekulo.
Lastnosti E2:
- Kinetika: hitrost je odvisna od koncentracije substrata in baze (rate = k[substrat][baza]).
- Geometrija: pogosto zahteva anti‑periplanar položaj H in odhajajoče skupine (posebej pomembno pri cikličnih sistemih ali v stolčni konformaciji cikloheksana: trans‑diaxialna orientacija).
- Substrati: sekundarni in terciarni alkili so pogosto najbolj primerni; primarni substrati običajno zahtevajo močno osnovo za E2.
- Baze: močne baze (npr. RO−, t‑BuO−) pospešujejo E2; sterično velike baze lahko favorizirajo Hofmannov produkt (manj substituiran alken) namesto bolj stabilnega (Zaitsev/Saytzeff) produkta.
Primer: dehidrohalogenacija alkilhalidov (npr. 2‑bromobutan → mešanica cis/trans‑2‑butena ali 1‑butena, odvisno od pogojev in baze).
Druge različice: E1cB in konkurenčne reakcije
Obstaja tudi mehanizem E1cB, kjer najprej nastane stabiliziran karbanion (prek odstranitve β‑protona), nato pa odide slaba odhajajoča skupina. To se pogosto pojavi pri spojinah z zakiseljenimi β‑protoni (npr. β‑diketonih ali nitro‑derivatih).
Pogoste konkurenčne poti so SN1 (pri istih razmerah kot E1) in SN2 (pri primarnih/sekundarnih substratih z močno nukleofilno bazo). Izbor topila, temperature in baze omogoča nadzor nad tem, katera pot bo prevladala.
Regio- in stereoselektivnost
- Zaitsevova (Saytzeffova) pravilo: pri zmanjšanju β‑protona se ponavadi oblikuje bolj substituiran, stabilnejši alken kot glavni produkt (razen kadar sterične ovire ali velike baze favorizirajo Hofmannov produkt).
- Stereoselektivnost: E2 daje stereokemično določen produkt, saj je potreben pravilen prostorski položaj H in odhajajoče skupine; v cikličnih sistemih je praviloma potreben trans‑pose (anti‑periplanar) za učinkovito eliminacijo.
Praktični nasveti
- Za pospešitev E2 uporabite močno, pogosto sterično bazo (npr. t‑BuOK v tert‑butanolu). Visoka temperatura običajno spodbuja eliminacijo pred substitucijo.
- Za E1 so primerni pogoji: šibkejše baze ali kislo okolje in polarno proticno topilo (npr. dehidracija alkoholov pri segrevanju z žveplovo kislino).
- Pri načrtovanju sinteze upoštevajte možnost karbokationih preureditvah pri E1 in geometrijske zahteve pri E2.
Na kratko: eliminacija je učinkovit način za tvorbo nezasičenih spojin. Mehanizmi E1 in E2 se razlikujeta po številu korakov, kinetiki, odvisnosti od baze in geometrijskih zahtevah; razumevanje teh razlik omogoča nadzor nad produktom in selektivnostjo reakcije. Pogosta reakcija izločanja poteka z alkoholi. Če je v bližini močna kislina, se lahko izloči molekula vode, ki tvori dvojno vez.
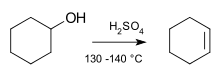
Reakcija eliminacije v molekuli cikloheksanola
Vprašanja in odgovori
V: Kaj je v organski kemiji eliminacijska reakcija?
O: Eliminacijska reakcija je reakcija, pri kateri iz večje molekule odvzamemo nekatere atome ali skupino atomov, pri čemer običajno nastane dvojna ali trojna vez.
V: Katera sta dva glavna načina za izvedbo eliminacijske reakcije?
O: Dva glavna načina za izvedbo reakcije eliminacije sta E1 in E2.
V: Kakšna je razlika med E1 in E2?
O: E1 poteka v dveh korakih, medtem ko E2 poteka samo v enem koraku. E1 vključuje izhodno skupino, ki sama odide, nato pa baza ali druga snov odvzame drugo skupino. Pri E2 baza odvzame eno skupino, hkrati pa odide tudi odhajajoča skupina.
V: Kdaj se zgodi običajna reakcija eliminacije?
O: Običajna reakcija eliminacije se zgodi pri alkoholih, kadar je v bližini močna kislina in se lahko izloči molekula vode, ki tvori dvojno vez.
V: Kaj je izstopajoča skupina pri reakciji eliminacije?
O: Odstopajoča skupina je molekula ali atom, ki lahko v reakciji eliminacije sam odide.
V: Kaj je baza v reakciji eliminacije?
O: Baza je snov, ki lahko v eliminacijski reakciji odvzame skupino.
V: Ali lahko pri reakciji eliminacije nastane trojna vez?
O: Da, pri reakciji eliminacije lahko nastane trojna vez.
Iskati