Kislina (kemija): definicija, pH, močne in šibke kisline
Kislina (kemija): definicija, pH, razlikovanje močnih in šibkih kislin, kako delujejo, merjenje pH in praktični primeri.
Članek o nekaterih lastnostih podatkovnih zbirk je na ACID
Včasih je kislina drugo ime za drogo LSD (dietilamid lizergične kisline)
Kislina je snov, ki lahko drugi snovi odda vodikov ion (H+ ) (običajno je to proton). Kisline imajo pH manj kot 7,0. Kemikalija lahko odda proton, če je vodikov atom vezan na elektronegativen atom, kot so kisik, dušik ali klor. Nekatere kisline so močne, druge šibke. Šibke kisline zadržijo nekaj svojih protonov, močne kisline pa jih vse oddajo. Vse kisline sproščajo vodikove ione v raztopine. Količina ionov, ki se sprostijo na molekulo, določa, ali je kislina šibka ali močna. Šibke kisline so kisline, ki delno sprostijo priključene vodikove atome. Te kisline torej lahko z disociacijo vodikovih ionov znižajo pH, vendar ne v celoti. Šibke kisline imajo običajno vrednost pH od 4 do 6, medtem ko imajo močne kisline vrednost pH od 1 do 3.
Kaj pomeni pH?
pH je mera kislosti raztopine in je definirana z izrazom pH = −log10[H+], kjer je [H+] koncentracija prostih vodikovih ionov v mol/L. pH = 7 velja za nevtralno (čista voda pri 25 °C), vrednosti nižje od 7 so kisle, vrednosti višje od 7 pa bazične (alkaline). Pomembno je razlikovati med jakostjo kisline (koliko se disociira v vodi) in koncentracijo kisline (koliko molov kisline je raztopljenih). Močna kislina pri zelo nizki koncentraciji lahko ima pH blizu nevtralnega, medtem ko šibka kislina pri visoki koncentraciji lahko povzroči precej nizk pH.
Definicije kislin
Obstajajo različne, vendar dopolnjujoče se kemijske definicije kislin:
- Arrhenius: kislina v vodi poveča koncentracijo H+ (ali hidronijevih ionov H3O+).
- Brønsted–Lowry: kislina je donor protona (H+), baza pa sprejemnik protona.
- Lewis: kislina je sprejemnik para elektronov, baza pa donor para elektronov.
Jakost kislin in konstanta disociacije
Jakost šibke kisline se pogosto opisuje s kislinsko konstanto Ka:
Ka = [A−][H+] / [HA]
Kjer je HA molekula kisline, A− njena konjugirana baza in [ ] označuje ravnovesno koncentracijo. Pogosteje se uporablja pKa = −log10(Ka); manjši pKa pomeni močnejšo kislino. Pri močnih kislinah je Ka zelo velik in ravnovesje je skoraj popolnoma na strani ionov.
Disociacija in poliprotične kisline
Kisline so lahko enoprotične (oddajo en proton), dvorotične ali večprotične (npr. žveplova kislina H2SO4 je diprotna). Pri poliprotičnih kislinah se protoni oddajajo zaporedno, z različnimi vrednostmi Ka za vsako stopnjo disociacije.
Primeri močnih in šibkih kislin
- Močne kisline: klorovodikova kislina (HCl), dušikova kislina (HNO3), žveplova kislina (H2SO4) — v vodi skoraj popolnoma disociirajo.
- Šibke kisline: ocetna kislina (CH3COOH), ogljikova kislina (H2CO3), fluorovodikova kislina (HF) — delno disociirajo in imajo značilne vrednosti Ka/pKa.
Konjugirane baze in kislinsko-bazično ravnovesje
Ko kislina HA odda proton, ostane konjugirana baza A−. Relativna stabilnost te baze (njihova sposobnost sprejemanja/ zadrževanja naboja) vpliva na moč kisline. Soli kislin z močnimi konjugiranimi bazami so običajno nevtralne, medtem ko soli z močnimi konjugiranimi kislinami lahko povzročijo zakisljevanje ali zasenčitev raztopine.
Merjenje pH in indikatorji
pH se meri z:
- kalibriranimi pH-elektrodami in merilniki (natančno merjenje),
- indikatorskimi papirčki (hitno, približno),
- indikatorskimi barvili (npr. fenolftalein, metil oranž), ki pokažejo prehod barve pri določenem pH-območju — uporabno pri titracijah.
Varnost in uporaba
Kisline so pomembne v industriji, laboratorijih in vsakdanjem življenju (npr. kislina v hrani, čiščenju, proizvodnji). Vendar so močne kisline korozivne in nevarne za kožo, oči in dihala. Pri delu s kislinami vedno uporabljamo ustrezno osebno zaščitno opremo (rokavice, očala, oblačila) in sledimo varnostnim postopkom, kot je raztapljanje kisline z dodajanjem kisline v vodo, ne obratno.
Uporabnost koncepta
Poznavanje razlik med močjo in koncentracijo kislin, ter uporaba definicij (Arrhenius, Brønsted–Lowry, Lewis) omogoča razumevanje reakcij v kemiji, biologiji (npr. encimske funkcije, pH v telesu), industriji (predelava, sinteza) in okolju (kislost padavin, nevtralizacija odpadnih voda).
Baza je "kemijsko nasprotje" kisline. Baza je snov, ki sprejme vodikov atom kisline. Baze so molekule, ki lahko v vodi razpadejo in sprostijo hidroksidne ione.

Klorovodikova kislina (v čaši) reagira s hlapi amonijaka, pri čemer nastane amonijev klorid (bel dim).
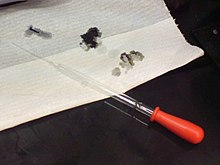
Kisline so lahko nevarne: Raztopina z 98-odstotno žveplovo kislino je naredila luknje v papirju.
Kako delujejo kisline
Kisline in baze običajno obstajajo skupaj v ravnovesju. To pomeni, da v vzorcu kisline nekatere molekule oddajajo svoje protone, druge pa jih sprejemajo. Tudi voda je mešanica kislega iona, H3 O+ (imenovanega hidronijev ion), in bazičnega iona, OH- (imenovanega hidroksidni ion). Hidronijev ion odda svoj proton hidroksidnemu ionu, pri čemer nastaneta dve molekuli H2 O, ki je nevtralen. Ta reakcija poteka v vzorcu vode neprekinjeno, vendar je vzorec na splošno nevtralen, ker je v njem enaka količina hidronija in hidroksida. Pri večini reakcij pa kisline in baze niso prisotne v enakih količinah in to neravnovesje omogoča potek kemijske reakcije.
Vsaka kislina ima konjugirano bazo, ki nastane z odstranitvijo njenega protona. Klorovodikova kislina (HCl) je na primer kislina, njena konjugirana baza pa je anion klora ali Cl-. Kislina in njena konjugirana baza sta si nasprotni po moči. Ker je HCl močna kislina, je Cl -šibka baza.
Lastnosti
Kisline so lahko različno močne, nekatere so bolj reaktivne kot druge. Bolj reaktivne kisline so pogosto nevarnejše.
Kisline imajo lahko veliko različnih lastnosti, ki so odvisne od njihove molekularne strukture. Večina kislin ima naslednje lastnosti:
- imajo pri uživanju kisel okus.
- lahko ob dotiku zbodejo kožo.
- lahko korodirajo (ali razjedajo) kovine in kožo.
- se lahko zaradi prisotnosti mobilnih ionov uporabi kot reaktant med elektrolizo
- modri lakmusov papir spremeni v rdečega
- na univerzalnem indikatorju se obarva rdeče ali oranžno.
- prevajajo elektriko.
Kisline lahko opečejo kožo, resnost opeklin pa je odvisna od vrste in koncentracije kisline. Te kemične opekline zahtevajo takojšnjo zdravniško pomoč.
Ker kisline oddajajo vodikove ione, morajo vse kisline vsebovati vodik.

Opozorilna slika, ki se uporablja z nevarnimi kislinami in nevarnimi bazami. Baze so nasprotje kislin.
Pomembnost
Kisline so pomembne. Nukleinske kisline, kot sta DNK in RNK, vsebujejo genetsko kodo. Te molekule določajo številne značilnosti organizma, prenašajo se s staršev na potomce. DNK vsebuje načrte, kako zgraditi beljakovine, ki so sestavljene iz aminokislin.
Maščobne kisline in derivati maščobnih kislin so še ena skupina karboksilnih kislin, ki imajo pomembno vlogo v biologiji. Vsebujejo dolge verige ogljikovodikov in skupino karboksilne kisline na enem koncu. Celično membrano skoraj vseh organizmov sestavlja predvsem fosfolipidni dvosloj, micel hidrofobnih verig maščobnih kislin s polarnimi, hidrofilnimi fosfatnimi "glavnimi" skupinami.
Klorovodikova kislina je pri ljudeh in številnih drugih živalih del želodčne kisline, ki se izloča v želodcu. Pomaga pri hidrolizi beljakovin in polisaharidov. Neaktivni proencim pepsinogen lahko pretvori v encim pepsin. Nekateri organizmi proizvajajo kisline za obrambo; na primer mravlje proizvajajo mravljinčno kislino, hobotnice pa črno kislino, imenovano magneta.
Večino kislin je mogoče najti v naravi. Nekatere med njimi so naslednje:
- Kis je verjetno eden najbolj znanih; vsebuje ocetno kislino, ki mu daje znani okus.
- Dušikova kislina, NHO, je znana 3že približno od 13. stoletja.
- Citronskekisline, C6 H8 O7, najdemo v številnih vrstah sadja. Verjetno jih je odkril Geber v 8. stoletju.
- Mlečno kislino, C3 H6 O3, je leta 1780 odkril Carl Wilhelm Scheele. Najdemo jo v kislih mlečnih izdelkih, kot je jogurt.
- Žveplovo kislino, H2 SO4, je verjetno odkril Geber. Danes jo najdemo v baterijah.
Sorodne strani
- Alkalije
- Folna kislina
Vprašanja in odgovori
V: Kaj je KISLINA?
O: ACID je članek o nekaterih lastnostih podatkovnih baz.
V: Kaj je kislina na splošno?
O: Kislina na splošno je snov, ki lahko drugi snovi odda vodikov ion (H+) in ima pH manj kot 7,0.
V: Kateri so pogoji, pod katerimi lahko kemikalija odda proton?
O: Kemikalija lahko odda proton, če je vodikov atom vezan na elektronegativen atom, kot so kisik, dušik ali klor.
V: Kakšna je razlika med močnimi in šibkimi kislinami?
O: Močne kisline izpustijo vse svoje protone, šibke kisline pa nekatere zadržijo. Količina ionov, ki se sprostijo na molekulo, določa, ali je kislina šibka ali močna.
V: Kakšen je razpon pH šibkih in močnih kislin?
O: Šibke kisline imajo običajno pH od 4 do 6, močne kisline pa od 1 do 3.
V: Kaj je baza?
O: Baza je "kemijsko nasprotje" kisline. Baza je snov, ki sprejme vodikov atom kisline. Baze so molekule, ki lahko v vodi razpadejo in sprostijo hidroksidne ione.
V: Kaj je LSD?
O: LSD (dietilamid lizergične kisline) je droga, ki se včasih imenuje kislina, vendar ni povezana s kislino, omenjeno v tem članku.
Iskati