Usmerjena evolucija: definicija, metode in uporaba pri razvoju encimov
Usmerjena evolucija: definicija, metode (in vivo/in vitro) in uporaba pri razvoju encimov za industrijske in medicinske namene.
Usmerjena evolucija (DE) je eksperimentalna metoda proteinskega inženiringa, ki posnema naravno selekcijo za hitrejši razvoj beljakovin, encimov ali funkcionalnih RNK za industrijske, medicinske in raziskovalne namene. Cilj je izboljšati lastnosti proteina — npr. katalitično aktivnost, stabilnost pri visokih temperaturah, specifičnost ali odpornost na topila — brez potrebe po popolnem razumevanju njegove strukture.
Osnovni cikel usmerjene evolucije
DE temelji na ponavljajočem se ciklu treh korakov:
- Generiranje variabilnosti: ustvarjanje knjižnice različic gena z mutacijami (naključne ali ciljno usmerjene).
- Izbor ali presejanje: testiranje članov knjižnice za iskano lastnost in izbira najboljših kandidatov.
- Amplifikacija in ponovitev: izbrane variante služijo kot predloge za naslednji krog mutacij in izbora.
Metode za ustvarjanje variabilnosti
Pogoste tehnike vključujejo:
- Napaka-vnosna PCR (error-prone PCR): poveča stopnjo napak pri amplifikaciji DNA in tako proizvaja naključne mutacije.
- Sitno usmerjene mutacije (site-directed / saturation mutagenesis): ciljano spreminjanje posameznih aminokislin ali pozicij v aktivnem mestu.
- DNA shuffling / rekombinacija: mešanje deležev sorodnih genov za ustvarjanje kombinatorične raznolikosti.
- Mutatorni sevi in kemijski mutageni: povečajo hitrost mutacij v celicah.
- Transpozoni in druge metode za vnos delecjev ali deležnih zamenjav.
Izvedba in vivo
DE se lahko izvaja in vivo, kar pomeni v živih celicah, najpogosteje v bakterijah ali kvasovk). Tipičen postopek:
- Vsaka celica je transformirana s plazmidom, ki vsebuje eno varianto iz knjižnice;
- celice izražajo beljakovino v citoplazmi ali na površini, kjer se lahko preveri funkcija;
- izbira poteka v celičnem okolju, kar je prednost, kadar želite, da protein deluje v živi celici ali organizmu (npr. zdravljenje ali biosinteza).
Izvedba in vitro
Pri in vitro usmerjeni evoluciji se beljakovine ali RNK sintetizirajo v celici neodvisnem sistemu z in vitro transkripcijsko-prevajalnim kompleksom. Prednosti:
- fleksibilnost pogojev (temperatura, topila, ionske razmere);
- možnost izražanja beljakovin, ki so za celice strupene;
- možnost ustvariti veliko večje knjižnice — do 10^15 članov — saj ni treba vložiti DNA v celice, kar omejuje velikost knjižnic pri in vivo pristopih.
Tipične in vitro metode vključujejo ribosome display, mRNA display in različne oblike in vitro kompartmentacije (mikrokapljice, emulzije), kjer je genotype-phenotype povezava ohranjena znotraj kapljic.
Izbor (selection) vs. presejanje (screening)
Uspeh DE močno temelji na načinu, kako merimo ali izbiramo želeno lastnost:
- Izbor: le preživeli ali razmnožljeni kandidati preidejo naprej (npr. rast na selektivnem mediju, kompementacija negacije). Primer: evolucija encima za novo substratno specifičnost z uporabo rastne selekcije.
- Presejanje: vsak član knjižnice se posamezno testira in ocenjuje (colorimetrično, fluorescenčno, z uporabo FACS, mikrotiter plošč, ali mikrokapljic). Primer: izbiranje varianti z izboljšano katalizo z uporabo fluorescenčnih substratov in FACS-sortiranja.
Napredne tehnike za visokozmogljivo presejanje
- FACS (fluorescenčno aktivacijsko sortiranje): omogoča hitro ločevanje milijonov celic glede na fluorescentni signal.
- Mikrofluidične kapljice in sortiranje kapljic: omogočajo kazalno ločevanje posameznih molekul ali celic v majhnih kapljicah pri hitrosti tisočih–milijonov/s.
- Next-generation sequencing (NGS) in deep mutational scanning: združitev selekcije s sekvenciranjem za kartiranje učinkov velikih števil mutacij in razumevanje pokrajine fitnessa.
Prednosti in omejitve
- Prednosti: ni potrebno podrobno strukturno znanje; lahko odkrijete nenavadne rešitve; primerna za izboljšanje kompleksnih lastnosti (npr. stabilnost, specifičnost).
- Omejitve: uspeh je odvisen od primerne selekcije ali presejalnega testa; lahko se zatakne pri lokalnih maksimumih (epistaza); nekatere želene lastnosti (npr. večdimenzionalne fenotipe) je težje meriti visoko-prezivno.
- Praktične omejitve: transformerabilnost celic omejuje velikost knjižnic in vivo, medtem ko so in vitro knjižnice večje, a zahtevajo drugačno infrastrukturo.
Tipične aplikacije
Usmerjena evolucija je bila uporabljena za:
- izboljšanje industrijskih encimov (npr. lipaze, proteaze, celulaze) za višjo aktivnost ali odpornost na topila;
- razvoj terapevtskih beljakovin in protiteles z večjo afiniteto ali specifičnostjo;
- optimizacijo metabolnih poti v celicah za proizvodnjo kemikalij in biogoriv;
- ustvarjanje biosenzorjev in molekul z novo funkcijo.
Nasveti za načrtovanje poskusa
- Jasno definirajte merilo uspeha in razvijte zanesljiv, kvantitativni presejalni ali selekcijski test.
- Začnite z raznoliko knjižnico — kombinacija naključnih in ciljno usmerjenih mutacij pogosto deluje najbolje.
- Nadzorujte stopnjo mutacij: previsoka stopnja lahko uniči osnovno funkcijo, prenizka pa upočasni napredek.
- Uporabljajte iterativne kroge z naravno ali umetno selekcijo in redno sekvencirajte obetavne kandidate.
- Povežite racionalno oblikovanje in DE: vnašanje znanih izboljšav ali omejitev prostora iskanja pogosto pospeši napredek.
Varnost in etika
Ker DE pogosto vključuje gensko spreminjanje organizmov, je pomembno upoštevati biosigurnostne standarde, regulative in etične smernice. Upoštevajte lokalne predpise glede dela z GMO, pravilno ravnajte z odpadki in zagotovite ustrezno laboratorijsko varnost.
Usmerjena evolucija je močno orodje za razvoj encimov in drugih bioloških makromolekul, ki združuje ustvarjalnost v eksperimentalnem načrtovanju s kvantitativnimi metodami presejanja in sodobnim sekvenciranjem. S premišljenim dizajnom knjižnice in ustreznim presejalnim korakom je mogoče doseči velike izboljšave lastnosti, potrebnih za industrijske in medicinske aplikacije.
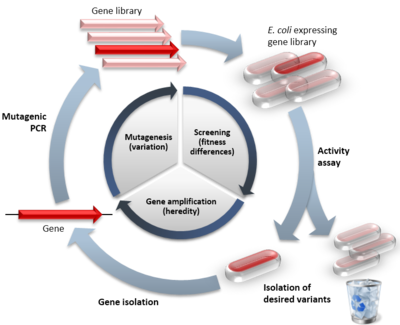
Primer usmerjene evolucije v primerjavi z naravno evolucijo. Notranji krog prikazuje tri stopnje cikla usmerjene evolucije, v oklepaju pa je posnemani naravni proces. Zunanji krog prikazuje korake v tipičnem poskusu. Rdeči simboli označujejo funkcionalne različice, bledi simboli pa različice z zmanjšano funkcijo
Zagotavljanje dednosti
Ko so izolirani funkcionalni proteini, je nujno, da so izolirani tudi njihovi geni, zato je potrebna povezava med genotipom in fenotipom.
To je lahko kovalentno, ko je gen mRNA na koncu prevajanja s puromicinom povezan z beljakovino.
Druga možnost je, da sta protein in njegov gen skupaj ali v emulzijskih kapljicah. Izolirana genska zaporedja se nato razmnožijo s PCR ali s transformiranimi gostiteljskimi bakterijami. Kot predlogo za naslednji krog mutageneze se lahko uporabi eno samo najboljše zaporedje ali skupina zaporedij. Zaradi ponavljajočih se ciklov diverzifikacija-selekcija-amplifikacija nastanejo encimske variacije, prilagojene selekcijskemu procesu.

Izražena beljakovina je lahko kovalentno povezana s svojim genom (kot mRNA), levo, ali pa je z njim v istem predelu, desno. V vsakem primeru je gen, ki kodira beljakovino, izoliran.
Podeljena nagrada
Ameriška inženirka Frances Arnold je prejela nagrado za tehnologijo tisočletja za pionirsko usmerjeno evolucijo.
Vprašanja in odgovori
V: Kaj je usmerjeni razvoj?
O: Usmerjena evolucija (DE) je metoda, ki se uporablja za proizvodnjo encimov za industrijske ali medicinske namene. Gre za obliko inženiringa proteinov, ki posnema naravno selekcijo.
V: Kako deluje usmerjena evolucija?
O: Usmerjena evolucija deluje tako, da se gen večkrat mutacijsko spreminja, s čimer se ustvari knjižnica različic. Izbor nato izloči gene z želeno funkcijo, ki se nato uporabijo kot predloge za naslednji krog.
V: Kje se lahko izvaja usmerjena evolucija?
O: Usmerjena evolucija se lahko izvaja in vivo (v živih celicah bakterij ali kvasovk) ali in vitro (prosto v raztopini ali mikrokapljicah).
V: Kakšne so prednosti usmerjene evolucije in vivo?
O: Prednost usmerjene evolucije in vivo je izbira lastnosti v celičnem okolju, kar je koristno, kadar je treba razviti protein ali RNK uporabiti v živih organizmih.
V: Katere so prednosti usmerjene evolucije in vitro?
O: Prednost usmerjene evolucije in vitro je, da omogoča več pogojev (npr. temperatura, topila) in lahko izraža beljakovine, ki bi bile za celice strupene. Poleg tega je mogoče ustvariti veliko večje knjižnice, ker DNK ni treba vstaviti v celice.
V: Kaj omejuje možnosti, ki jih je mogoče narediti med poskusom in vitro?
O: Omejitev velikosti tega, kar je mogoče narediti med poskusom in vitro, je pogosto določena s tem, koliko DNK je treba vstaviti v celice.
Iskati