Sulfoksid: definicija, struktura, lastnosti in uporaba v kemiji (DMSO)
Sulfoksid (DMSO): definicija, struktura, fizikalno-kemijske lastnosti in uporaba v kemiji. Spoznajte kiralnost, ligandno vlogo in uporabo kot univerzalno topilo.
Sulfoksid je molekula, ki ima žveplov atom vezan na dva ogljika in en kisikov atom. Nastane pri oksidaciji tioetrov, ne da bi prišli do sulfona. Kot mnoge molekule, ki vsebujejo žveplo, lahko sulfooksid včasih močno smrdi.
Sulfokside lahko zapišemo s splošno formulo R-S(=O)-R'. Žveplo ima dvojno vez s kisikom in enojno vez z ogljikovimi hidrati. Tako na atomu ostane samotni par. To pomeni, da je oblika tega atoma tetraedrična. To tudi pomeni, da je žveplo lahko kiralno središče. Sulfoksidi se uporabljajo kot dobri ligandi za prehodne kovine.
Pomembna molekula te vrste je dimetilsulfoksid. Imenuje se tudi DMSO. Uporablja se kot topilo za številne reakcije, zlasti v biokemiji.
Struktura in stereokemija
Sulfoksidi imajo splošno formulo R–S(=O)–R'. Kisik je vezan na žveplo z vezjo, ki ima precejšnje π-značilnosti (delna dvojna vez), zaradi česar je S=O polarna skupina z delnim nabojem Sδ+–Oδ−. Žveplov atom nosi tudi en samotni par, zato je njegova geometrija približno tetraedrična (piramidna). Formalna oksidacijska stopnja žvepla v sulfoksidih je +4.
Sulfoksidi so pogosto stereogeni pri žveplu: žveplo je lahko kiralno središče, kadar sta substituenta R in R' različna. Bariera za inverzijo (prevrnitev konfiguracije pri žveplu) je običajno dovolj visoka, da so enantiomeri oftalmološko ločljivi in stabilni pri sobni temperaturi, zato se sulfoxidi pogosto uporabljajo v asimetrični sintezi kot kiralni gradniki ali ligandi.
Kemijske lastnosti in tipične reakcije
- Oksidacija in redukcija: Sulfoksidi nastanejo z oksidacijo tioeterov (tioetrov) in jih je mogoče naprej oksidirati do sulfonov (R–S(=O)2–R'). Prav tako je možna redukcija sulfoksidov nazaj na sulfide.
- Pummererjeva preureditev: Sulfoksidi lahko sodelujejo v Pummererjevih reakcijah, kjer delno oksidirani produkti in aktivacija sulfoxida vodijo do preselitve substituentov v alfa-položaje ogljikov.
- Deprotonacija alfa ogljikov: Vodiki alfa na ogljikih ob žveplu so pogosto kisli in jih je mogoče deprotonirati z močnimi bazami, kar omogoča tvorbo karbanionov uporabnih v raznih C–C vezavah in v sintetskih metodah.
- Koordinacijska kemija: Sulfoksidi (preko kisika ali žvepla) tvorijo stabilne komplekse z prehodnimi kovinami in se uporabljajo kot ligandi v katalizi ter v stabilizaciji kovinskih središč.
Sinclairna priprava
Pogoste metode za pripravo sulfoksidov vključujejo selektivno oksidacijo tioeterov z oksidanti, kot so vodikov peroksid (H2O2), perkisline (npr. mCPBA) ali drugi blagi oksidanti. Kadar je ciljni produkt sulfoksid in ne sulfon, je pomembna kontrola pogojev (temperatura, količina oksidanta) za preprečitev prenapredne oksidacije.
DMSO — fizikalne lastnosti in uporabe
Dimetilsulfoksid (DMSO) je eden najbolj razširjenih sulfoksidov v praksi. Njegova kemijska formula je (CH3)2SO. DMSO je polarno aprotično topilo, dobro topno v vodi in mnogih org. topilih, kar ga naredi zelo uporabnega v organski sintezi in biokemijskih postopkih. Nekatere pomembne lastnosti DMSO:
- Visoka polariteta in velika dielektrična konstanta, zato dobro raztopi ionske in polarne spojine.
- Visoka vrelišče (~189 °C) in relativno nizka strmost za hlajenje; topilo je tekoče v širokem območju temperatur (stalno tekoče pri večini laboratorijskih pogojev; tališče približno 18 °C).
- Uporablja se kot topilo pri reakcijah, kot so nukleofilne substitucije, oksidacije in kot topilo za spektroskopijo (NMR), kjer ima značilen residualni signal.
- V biomedicini se DMSO uporablja tudi kot penetrant (pospeši prehajanje snovi skozi kožo), kot cryoprotectant pri zamrzovanju celic in kot topilo pri pripravi bioloških vzorcev.
Uporaba v kemiji in industriji
Sulfoksidi imajo širok spekter uporab:
- Kot topila (npr. DMSO) v organski sintezi, farmaciji in biokemiji.
- Kot ligandi v kompleksih s prehodnimi kovinami, kjer lahko vplivajo na reaktivnost in selektivnost katalitskih procesov.
- Kot posredniki v organskih transformacijah (npr. Pummererjeva reakcija, oksidacije, nekatere povezovalne reakcije).
- Kot farmacevtske aktivne snovi ali kot pomocne snovi v zdravilih in terapevtskih formulacijah; nekateri sulfoxidi imajo farmakološko aktivnost.
Varnost in ravnanje
Sulfoksidi so kemično raznoliki glede toksičnosti; posebna pozornost velja za DMSO, ker se hitro absorbira skozi kožo in lahko prenaša topne snovi v krvni obtok. Zato je pri delu z DMSO pomembno uporabljati zaščitne rokavice in paziti, da topilo ne pride v stik z nezaželenimi snovmi na koži. Pri proizvodnji in uporabi večjih količin je treba upoštevati tudi ustrezno prezračevanje in ravnanje z odpadki.
Povzetek
Sulfoksidi so vsestranski in kemijsko aktivni derivati žvepla z obročnim S=O prehodom, značilno polarno vezjo in možnostjo kiralnosti pri žveplu. Njihova uporaba sega od topil in ligandov do reagenti v sintetskih protokolih in aplikacij v biologiji in medicini — na primer dimetilsulfoksid (DMSO) kot zelo pomembno topilo in pomočno sredstvo v laboratorijih in industriji.
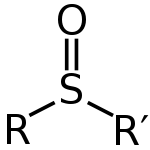
Splošna struktura sulfooksida
Vprašanja in odgovori
V: Kaj je sulfooksid?
O: Sulfoksid je molekula, ki ima žveplov atom vezan na dva ogljika in en kisikov atom.
V: Od kod prihaja sulfooksid?
O: Sulfosoksid nastane pri oksidaciji tioetrov, ne da bi prišel do sulfona.
V: Kakšna je splošna formula za sulfookside?
O: Splošna formula za sulfookside je R-S(=O)-R'.
V: Kakšna je oblika atoma v sulfooksidih?
O: Oblika atoma v sulfooksidih je tetraedrična.
V: Ali je lahko žveplo kiralno središče v sulfooksidih?
O: Da, žveplo v sulfooksidih je lahko kiralno središče.
V: Kaj je dimetilsulfoksid in kakšna je njegova uporaba?
O: Dimetilsulfoksid, znan tudi kot DMSO, je pomembna molekula sulfoksida in se uporablja kot topilo za številne reakcije, zlasti v biokemiji.
V: Zakaj se sulfooksidi uporabljajo kot dobri ligandi za prehodne kovine?
O: Sulfoksidi se uporabljajo kot dobri ligandi za prehodne kovine, ker se zaradi elektronskega para na atomu žvepla lahko koordinirajo s kovinskimi ioni.
Iskati