Keratin: vlaknata beljakovina — struktura, lastnosti in vloga
Odkrijte strukturo, lastnosti in vlogo keratina — vlaknate beljakovine, ki gradi dlako, nohte, roge in perje; znanstven pregled in praktične informacije.
Keratini so družina vlaknatih beljakovin. Iz keratina je sestavljena živalska dlaka, rogovi, nohti, kopita, lupine, kljun in perje. Ime izvira iz grške besede keras, ki pomeni "rog".
Keratini so čvrsti in netopni. Sestavljajo trde, vendar nemineralne strukture pri plazilcih, pticah, dvoživkah in sesalcih. Podobno biološko trdnost ima tudi hitin.
Struktura keratina
Keratini so vlaknate (fibrozne) beljakovine, ki tvorijo intermediarne filamente v celični strukturi in so sestavljeni iz dolgih polipeptidnih verig. Osnovna enota večine keratinov so dimeri, v katerih se dve alfa‑vijačni (coiled‑coil) verigi navijeta skupaj. Ti dimeri se nato organizirajo v protofilamente in naposled v intermediarne filamente premera približno 10 nm. Keratini so bogati z aminokislino cistein, ki omogoča tvorbo disulfidnih (S–S) vezi med verigami in daje materialu dodatno trdnost.
Pomembna taksonomska razlika je med alfa‑keratinom (prevladuje pri sesalcih — dlaka, nohti, rogi) in t. i. beta‑keratinom oziroma korneusnimi beta‑proteini (trdnejši beta‑plošče, najdemo jih pri pticah in plazilcih v perju, luski, krempljih). Beta‑strukture dajejo materialu večjo krhkost in trdnost v primerjavi z elastičnejšimi alfa‑vijačnimi strukturami.
Lastnosti
- Netopnost in odpornost: keratini so netopni v vodi in večini običajnih topil; zaradi močnih disulfidnih vezi in gostih medmolekularnih interakcij so odporni proti encimskemu razgradnji brez predhodne obdelave.
- Mehanske lastnosti: variabilne — od prožne dlake do trdih nohtov in kopit; gostota disulfidnih vezi in tip sekundarne strukture (alfa vs. beta) določata togost in krhkost.
- Topnost obdelave: kemično razbijanje S–S vezi (z reducenti kot sta β‑merkaptoetanol ali ditiotreitol), močne baze, visoke temperature ali posebne encime (keratinaze) lahko razgradijo oziroma raztopijo keratin.
Biološka vloga
Keratini dajejo mehansko zaščito in podporo površinskim strukturam telesa: ščitijo pred obrabo, poškodbo in vdorom mikroorganizmov ter omogočajo specializirane funkcije — perje pri pticah za letenje in izolacijo, kljun za prehranjevanje, rogi in kopita za obrambne ali podporne naloge. V celičnem tkivu keratini (kot del citoskeleta) pomagajo ohranjati obliko celic in odpornost proti mehanskim napetostim.
Sinteza in kemične vezi
Keratini so produkta ribosomskega prevajanja genetskega zapisa. Po sintezi sledijo postopki zorenja in cross‑linkanja, kjer so pomembne vezi med cisteinskimi ostanki — disulfidne vezi, ki močno povečajo neprepustnost in trdnost strukture. Različne stopnje oksidacije in gostota S–S vezi pojasnjujejo, zakaj so nekateri keratini bolj trdi (npr. rogi) kot drugi (npr. dlaka).
Bolezni in motnje
Mutacije v genih za keratinske proteine lahko povzročijo več kožnih bolezni in motenj strukture: primeri vključujejo obstoj bolezni, povezanih s krhkimi nohti, lomljivostjo dlak ali posebne sindrome (npr. nekatere oblike epidermolize). Keratinopatije se pogosto kažejo kot povečana lomljivost ali ranljivost tkiv, ki morajo prenašati mehanske obremenitve.
Aplikacije in trajnost
Keratinske snovi imajo številne industrijske in kozmetične uporabe: izvlečki keratina se uporabljajo v tretmajih za lase, v medicinskih oblogah in kot biomateriali za tkivne inženirske mreže, filmčke in obliže. Keratin iz kmetijskih odpadkov (perje, dlaka) se predela s hidrolizo ali biološko z uporabo keratinaz ter reciklira kot beljakovinski dodatek v krmi, gnojilo ali kot surovina za materialno znanost.
Razgradnja in ekološki vidik
Čeprav je keratin odporen na običajne razgradne poti, obstajajo mikroorganizmi (bakterije in glive) s keratinazami, encimi, ki lahko cepijo keratin in omogočijo biološko recikliranje perja, dlake in drugih keratinskih odpadkov. Tako je možno zmanjšati okoljski odtis industrijskih odpadkov z ustreznimi biotehnološkimi rešitvami.
Na kratko: keratini so ključne vlaknate beljakovine, bogate s cisteinom, odgovorne za trdnost in zaščitne lastnosti mnogih živalskih struktur. Njihova raznolikost — od prožnih alfa‑vijačnih oblik do trdnih beta‑ploskov — omogoča širok razpon bioloških funkcij in tehnoloških uporabe.
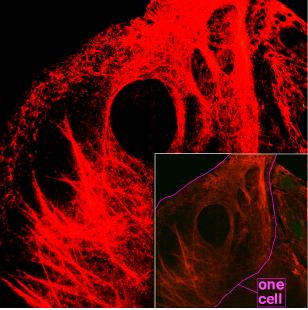
Mikroskopiranje keratinskih filamentov v celicah.
Različna uporaba za živali
Keratini so glavna sestavina struktur, ki rastejo iz kože:
- α-keratini v laseh (vključno z volno), rogovih, nohtih, krempljih in kopitih sesalcev.
- trši β-keratini v luskah in krempljih plazilcev, njihovih lupinah (chelonia, kot so želva, želva, terrapin) ter v perju, kljunu in krempljih ptic. Ti keratini so v glavnem sestavljeni iz beta listov. Vendar so beta listi tudi v α-keratinih.
Pri členonožcih, kot so raki, so deli eksoskeleta pogosto iz keratina, včasih v kombinaciji s hitinom.
Keratine najdemo tudi v prebavilih številnih živali, vključno z glistami (tudi te imajo zunanjo plast iz keratina).
Čeprav je to danes težko zanesljivo ugotoviti, so bile luske, kremplji, nekateri zaščitni oklepi in kljun dinozavrov skoraj zagotovo sestavljeni iz vrste keratina.
Svila
Svileni fibroini, ki jih proizvajajo žuželke in pajki, se pogosto uvrščajo med keratine, čeprav ni jasno, ali so filogenetsko povezani s keratini vretenčarjev.
Svila, ki jo najdemo v žuželčjih mladičih, pajčjih mrežah in jajčnih ovojih, ima prav tako zvite β-napetke, ki so vključeni v vlakna, zvita v večje supermolekularne agregate.
Iskati