Molekulske vibracije: definicija, vrste in primeri gibanja vezi
Molekulske vibracije: jasna definicija, vrste in praktični primeri gibanja vezi (raztezanje, upogib) — enostavno razloženo za študij in raziskave.
Molekulske vibracije so ena od treh osnovnih vrst gibanja molekul, poleg translacijskega gibanja (ko se celotna molekula premika v prostoru) in rotacijskega gibanja (ko se molekula vrti okoli osi). Vibracijsko gibanje opisuje premike vezi in relativne položaje atomov v molekuli — atome si lahko predstavljamo kot kroglice, povezane z vzmetmi, ki se lahko raztezajo in krčijo. Najpreprostejši primer je raztezanje vezi med dvema atomoma, kot pri diatomskih molekulah: vodik H2, dušik N2 in kisik O2.
Kaj so normalne mode in kvantizacija energije
Vsaka molekula ima določeno število neodvisnih vibracijskih vzorcev, imenovanih normalne mode. V klasičnem pogledu so to kolektivni premiki atomov, pri katerih vsi atomi nihajo s isto frekvenco. V kvantni mehaniki so te vibracije kvantizirane: energija vibracij je diskretna in je za harmonski oscilator dana z izrazom E = (n + 1/2) hν, kjer je n kvantno število, h Planckova konstanta in ν frekvenca vibracije. Frekvenco približno določimo z vzmetno konstanto vezi k in reducirano maso μ dveh sodelujočih atomov: ν ≈ (1/2π) √(k/μ). Zaradi kvantizacije obstaja tudi ničelna energija (zero-point energy), torej molekula ni povsem mirovala tudi v osnovnem stanju.
Koliko vibracij ima molekula?
Število normalnih modov je odvisno od števila atomov N v molekuli in njene geometrije:
- nelinearna molekula: 3N − 6 vibracijskih načinov;
- linearna molekula: 3N − 5 vibracijskih načinov (ena rotacijska stopnja svobode manj).
Vrste vibracij
Običajno ločimo osnovne tipe vibracij, ki se pojavljajo kot normalne mode:
- Raztezanje (stretching) — sprememba razdalje med dvema atomoma. Lahko je simetrično (več vezi se razteza in krči istočasno) ali asimetrično (ene vezi se raztezajo, druge krčijo).
- Upogibanje (bending) — sprememba kota med vezmi. Podvrste so scissoring (škarjasta), rocking (gugalna), wagging (mahanje) in twisting (zavijanje).
- Izvenplaščinske (out-of-plane) vibracije — atomi se premikajo iz ravnine molekule.
- Torzijone (torsional) — rotacija okoli vezne osi (pomembno pri velikih organskih molekulah).
Spektroskopija: kako merimo vibracije
Vibracije so osnova infrardeče (IR) in Ramanove spektroskopije. Pri IR-spektroskopiji absorbcija elektromagnetnega valovanja povzroči prehod v višje vibracijsko stanje, vendar je pogoj za IR-aktivnost sprememba dipolnega momenta med vibracijo. Ramanova spektroskopija zaznava spremembe v polarizabilnosti molekule in zato pogosto dopolnjuje IR. Za idealen harmonski oscilator je pravilo za prehode Δv = ±1, vendar anhamoničnost omogoča tudi overtone (Δv = ±2, ±3 …) in kombinirane pasove.
Primeri vibracij v znanih molekulah
- Diatomske molekule (vodik H2, dušik N2, kisik O2) imajo samo en vibracijski način — raztezanje/krčenje vezi.
- CO2 (linearna): ima simetrično raztezanje (IR-inaktivno, Raman-aktivno), asimetrično raztezanje (IR-aktivno) in dva enaka upogibna načina (degenerirana).
- H2O (nelinearna): tri vibracijske mode — simetrično in asimetrično raztezanje ter upogibanje (bending); vse so IR-aktivne zaradi spremembe dipolnega momenta.
- CH skupine in organski funkcionalni skupini: C–H, O–H in N–H vezi dajejo značilne pasove v IR spektru; torzijske in upogibne mode pogosto določajo obliko večjih molekul.
Zakaj so molekulske vibracije pomembne?
Razumevanje vibracij je ključno za interpretacijo spektrov, določanje strukture molekul, preučevanje kemijskih vezi in reakcijskih poti ter za aplikacije v materialih, biokemiji in analitični kemiji. Vibracijske značilnosti nam povedo o jakosti vezi, masi atomov in simetriji molekule, zato so nepogrešljivo orodje v raziskavah in industriji.
Za dodatno poglobitev lahko raziščete pojme, kot so vibracije v kvantni mehaniki, normalni načini ter eksperimentalne metode za njihovo merjenje.
Vrste vibracij
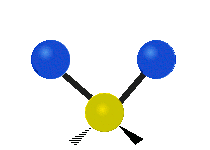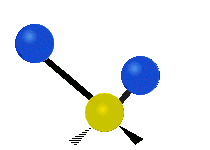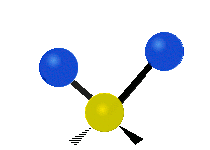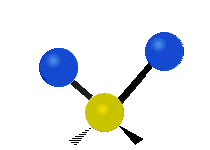
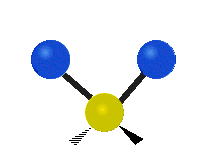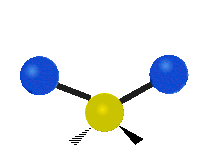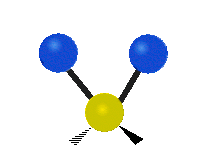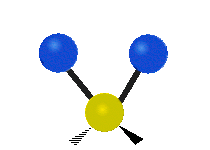
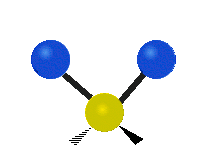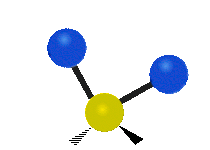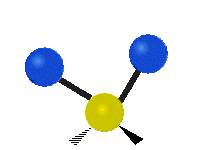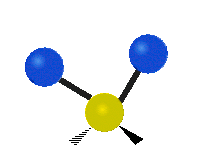
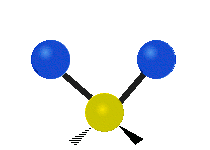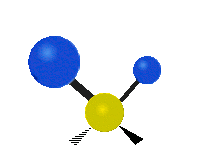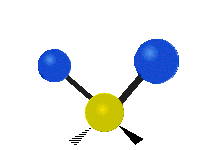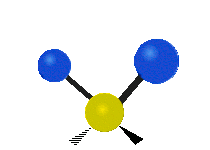
Če ima molekula več kot dva atoma, se stvari še bolj zapletejo. Recimo, da dodamo samo še en atom, tako da imamo zdaj tri atome, kot v vodi H2 O, kjer sta oba vodikova atoma povezana z osrednjim kisikovim atomom. Spomnite se, da je bila pri vodiku ena vrsta raztezanja, v vodi pa sta dve vrsti raztezanja in štiri druge vrste vibracij, imenovane upogibne vibracije, kot je prikazano spodaj.
Atomi v skupini CH2 ali molekulah, kot je voda, lahko vibrirajo na šest različnih načinov: simetrično in antisimetrično raztezanje, škarje, zibanje, zibanje in zvijanje:
| Simetrično raztezanje | Antisimetrično raztezanje | Škarje |
|
|
|
|
| Rocking | Wagging | Twisting |
|
|
|
|
simetrično raztezanje: ko se oba pritrjena atoma istočasno oddaljujeta in približujeta osrednjemu atomu.
antisimetrično raztezanje: ko se oba pritrjena atoma ne oddaljujeta in približujeta osrednjemu atomu hkrati.
škarje: Kot pove že ime, se škarje razmaknejo, ko se dva atoma oddaljita in približata drug drugemu.
zibanje: le da je tu nihalo atom in sta dva namesto enega.
mahanje: Če oseba dvigne roko pred sabo in postavi dva prsta v obliki črke "V" ter upogne zapestje proti sebi in stran od sebe. Pri tem sta konici prstov pritrjena atoma, zapestje pa je osrednji atom.
zvijanje: To gibanje je, kot da bi oseba hodila po tekočem traku, pri čemer je njen pas osrednji atom, stopala pa sta dva pritrjena atoma.
Molekule z več kot tremi atomi
Molekule z več kot tremi atomi so še bolj zapletene in imajo še več vibracij, ki jih včasih imenujemo "vibracijski načini". Vsak nov vibracijski način je v bistvu drugačna kombinacija šestih, ki so prikazani zgoraj. Več kot je atomov v molekuli, več načinov je mogoče kombinirati. Za večino molekul z N atomi je število možnih vibracij te molekule 3N - 6, medtem ko imajo linearne molekule ali molekule z atomi v ravni črti 3N-5 vibracijskih načinov.
Razmerje med energijo in vibracijami
Newtonova mehanika
Vibracije molekule lahko izračunamo z Newtonovo mehaniko, tako da vezi obravnavamo kot vzmeti. To je koristno, saj je tako kot pri vzmeti tudi pri vezi potrebna energija, da se raztegne, in energija, da se stisne skupaj. Energija, ki je potrebna za raztezanje ali stiskanje vezi, je odvisna od togosti vezi, ki jo predstavlja vzmetna konstanta k, in reducirane mase ali "masnega središča" dveh atomov, priključenih na obeh koncih, označene z μ. Enačba, ki se uporablja za povezovanje energije, potrebne za povzročitev vibracij v vezi, je:
E = h ν = h 2 π k μ . {\displaystyle \ E=h\nu ={h \over {2\pi }}{\sqrt {k \over \mu }}.\! }
h: je Planckova konstanta
ν: je frekvenca in predstavlja hitrost, s katero se vez stisne skupaj in spet razdruži. Večja kot je ν, hitrejša je ta hitrost.
Ε: je energija, ki je potrebna za potiskanje in vlečenje vezi.
μ: Močno zmanjšana masa je masa dveh atomov, pomnožena skupaj in deljena z njunim seštevkom:
μ = m 1 m 2 m 1 + m 2 . {\displaystyle \mu ={m_{1}m_{2} \over m_{1}+m_{2}}.\! }
Kvantna mehanika
Pri uporabi kvantne mehanike je formula, ki opisuje vzmet, popolnoma enaka kot pri Newtonovi mehaniki, le da so dovoljene le določene energije ali energijske ravni. Ravni energije si predstavljajte kot stopnice na lestvi, po kateri se lahko človek povzpne ali spusti le po eni stopnici naenkrat. Tako kot ta oseba ne more stati na prostoru med stopnicami, tako tudi vez ne more imeti energije med energijskimi ravnmi. Ta nova formula postane:
E n = h ν = h ( n + 1 2 ) 1 2 π k m {\displaystyle E_{n}=h\nu =h\left(n+{1 \over 2}\right){1 \over {2\pi }}{\sqrt {k \over m}}\! } 
kjer je n kvantno število ali "energijska raven", ki ima lahko vrednosti 0, 1, 2 ... Trditev, da se lahko energijski nivoji naenkrat dvignejo ali spustijo le za en nivo, je znana kot izbirno pravilo, ki pravi, da so edini dovoljeni prehodi med energijskimi nivoji:
Δ n = ± 1 {\displaystyle \Delta n=\pm 1}
kjer je \Delta n energijski prehod.
Uporaba vibracijskih gibanj
Ko svetloba določene frekvence pade na molekulo, ki ima vibracijo, katere gibanje ustreza isti frekvenci, se svetloba absorbira v molekulo in energija svetlobe povzroči, da se vezi premikajo v skladu z določenim vibracijskim gibanjem. S preverjanjem svetlobe, ki se absorbira, lahko znanstveniki ugotovijo, ali obstaja določena vrsta molekulske vezi, in jo primerjajo s seznamom molekul, ki imajo takšno vez.
Nekatere molekule, kot sta helij in argon, imajo samo en atom in nimajo vezi. To pomeni, da ne absorbirajo svetlobe tako kot molekule z več kot enim atomom.
Posebni področji kemije, ki pri svojih študijah uporabljata molekulske vibracije, sta infrardeča spektroskopija (IR) in Ramanova spektroskopija (Raman), pri čemer se IR uporablja bolj pogosto in ima tri lastna podpodročja. Ta podpodročja so znana kot bližnja IR, srednja IR in daljna IR spektroskopija. V nadaljevanju je splošni seznam teh področij in aplikacij v resničnem svetu
Blizu IR: kvantitativno določanje vrst, kot so beljakovine, maščobe, ogljikovodiki z nizko nizko molekulsko maso in voda. Nadaljnja uporaba je mogoča v kmetijski, živilski, naftni in kemični industriji.
Srednja IR: Najbolj priljubljeno področje IR se uporablja pri določanju strukture organskih in biokemičnih spojin.
Daljinski IR: to področje je manj priljubljeno, čeprav se uporablja v anorganskih študijah.
Raman: Uporablja se za kvalitativno in kvantitativno preučevanje anorganskih, organskih in bioloških sistemov, pogosto kot dopolnilna tehnika IR.
Iskati