Atomske orbitale: definicija, vrste in pomen v kvantni mehaniki
Atomske orbitale: jasna definicija, vrste in vloga v kvantni mehaniki. Razložene elektronske konfiguracije, valovne funkcije in pomen pri spektroskopiji.
Atomske orbitale so porazdelitve verjetnosti okoli jedro atoma, kjer se elektroni v danem trenutku najverjetneje nahajajo. Atomskih orbital ne smemo razumeti kot trajektorij — niso poti, po katerih bi elektroni krožili — temveč kot vrednosti valovne funkcije ψ, katere kvadrat |ψ|² daje gostoto verjetnosti. Orbitala je v kvantni mehaniki opisana z matematično funkcijo, ki opisuje valovno obnašanje enega elektrona ali para elektronov v atomu in je rešitev Schrödingerjeve enačbe za ta sistem.
Izvor izraza in zgodnji modeli
Izraz "orbitalni" izhaja iz zgodnejših predstav, kjer so fiziki primerjali obnašanje elektronov z gibanjem planetov okoli sonca. Tako so nekoč menili, da se elektroni krožijo okoli jedra podobno kot planeti okoli zvezde (podobno kot v sončnem sistemu). Kvantna mehanika je ta poenostavljeni pogled nadomestila z verjetnostnim opisom orbit, kar bolje pojasni opazene lastnosti atomov in spektrov.
Kvantna števila in osnovne lastnosti
Vsaka atomska orbitala je določena s sklopom kvantnih števil: glavno kvantno število n (energijska raven), orbitalno (azimutno) kvantno število l (podnivo, oblika orbite), magnetno kvantno število m (orientacija orbite) in spin s (lastnost delca). V okviru atomske teorije in kvantni mehaniki je orbitala povezana z vrednostmi teh kvantnih števil — vsako konfiguracijo kvantnih števil predstavlja eno orbitalo. Vsako takšno orbitalo lahko zasedata največ dva elektrona z nasprotnima spinoma (Pauli ekskluzijski princip).
Vrste orbital (s, p, d, f) in oblike
Podnivoje običajno označujemo s črkami s, p, d, f (in nadalje):
- s-orbitala: sferično simetrična, en orbital na vsakem n (n = 1, 2, 3,...).
- p-orbitali: tri orientacije (m = −1, 0, +1), oblikovani kot bučke ob suglasni osi.
- d-orbitali: pet orientacij, kompleksnejša oblika z dvema ali več vozlišči.
- f-orbitali: še bolj zapletene oblike, pomembne pri težjih elementih.
Oblike orbital so vidne, če narišemo površine konstantne vrednosti verjetnosti (konture gostote). Orbitali imajo tudi vozlišča (node): radialne (kjer se verjetnost ničelno spreminja radijalno) in kotne (kjer se valovna funkcija spremeni s smerjo).
Energija, degeneracija in mnogoelektronski atomi
V enoelektronskem atomu (npr. vodik) je energija določena samo z glavnim kvantnim številom n, zato so orbitali z istim n degenerirani. V mnogoelektronskih atomih pa medsebojna odbijanja elektronov povzročijo odvisnost energije tudi od l; zato so ravni razdeljene in zaporedje polnjenja sledi pravilom, kot sta Aufbau in Hundovo pravilo. Število orbital v lupini n je n², število orbital v posameznem podnivoju pa je 2l+1.
Razporeditev elektronov in spektroskopija
Način razporeditve elektronov po orbitalah je povezan z elektronskimi konfiguracijami atomov. Izhaja iz eksperimentalnih in teoretičnih ugotovitev, vključno z opisom spektroskopskih črt, ki so jih zgodnji spektroskopisti opisali kot ostre, glavne, razpršene in osnovne — opisi, iz katerih so alkalijskih kovin, ki so jih opazovali, pomagali razviti razumevanje podnivojev in prehodov med njimi.
Pravila, ki določajo zasedanje orbital, vključujejo Pauli ekskluzijski princip (maksimum dva elektrona na orbitalo z nasprotnima spinoma), Hundovo pravilo (najvišja multiplicitetna konfiguracija zasede orbitale podnivoja s čim več posameznimi elektroni) in načelo minimizacije energije (elektroni zapolnjujejo najnižje razpoložljive ravni).
Pomen v kemiji in materialih
Atomske orbitale so osnova za razumevanje kemijskih vezi: v molekulah se atomske orbitale lahko kombinirajo v molekulske orbitalne, ki določajo jakost in geometrijo vezi (sigma, pi, δ vezi itd.). Oblika in energija orbital določata reaktivnost, magnetne lastnosti in barve snovi ter igrajo ključno vlogo pri katalizi, prevodnosti in optičnih lastnostih materialov.
Vizualizacija in meritve
Orbitali običajno vizualiziramo z gostotami verjetnosti ali faznimi površinami. Spektroskopske tehnike (npr. atomska absorpcija, emisija, fotoelektronska spektroskopija) in sodobne računske metode (kvantnokemijske simulacije, gostotna funkcionalna teorija) omogočajo določitev energij in oblike orbital ter njihovo vlogo v kemijskih procesih.
Povzetek
Atomske orbitale so temeljni koncept kvantne kemije in fizike: matematične funkcije, ki opisujejo verjetnostno porazdelitev elektronov okoli jedra. Razumevanje njihovih kvantnih števil, oblik in energij omogoča napovedovanje elektronskih konfiguracij, kemijskih vezi in spektroskopskih lastnosti snovi.
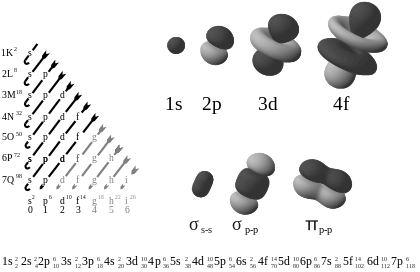
Na diagramu na levi strani so orbitale prikazane po naraščajoči energiji. Na desni so primeri oblik orbital.
Sorodne strani
- Elektronski oblak
- Molekulska orbitala
Vprašanja in odgovori
V: Kaj so atomske orbitale?
O: Atomske orbitale so območja okoli jedra atoma, kjer se najverjetneje nahajajo elektroni.
V: Kakšna je matematična funkcija, ki opisuje obnašanje elektronov v atomu?
O: Matematična funkcija, ki opisuje obnašanje elektronov v atomu, je valovna funkcija.
V: Zakaj se uporablja beseda "orbital"?
O: Beseda "orbitalni" se uporablja za opis območij okoli jedra, kjer se elektroni najverjetneje nahajajo, ker so nekoč verjeli, da se elektroni obnašajo kot planeti, ki krožijo okoli sonca.
V: Kako je določeno število atomskih orbital v elementu?
O: Število atomskih orbital v elementu je določeno s periodo elementa.
V: Zakaj se elektroni premikajo med orbitali?
O: Elektroni se gibljejo med orbitali glede na svojo hitrost in število drugih prisotnih elektronov.
V: Kaj je atomska orbitala v atomski teoriji in kvantni mehaniki?
O: Atomska orbitala je kvantno število v atomski teoriji in kvantni mehaniki.
V: Koliko elektronov lahko zasede vsako atomsko orbitalo?
O: Vsaka atomska orbitala je lahko zasedena z enim ali dvema elektronoma.
Iskati