Atomska teorija - definicija, zgodovina in zgradba atomov
Atomska teorija: definicija, zgodovina in zgradba atomov — od Demokrita do sodobnih modelov; protoni, nevtroni, elektroni in kvarki razloženi jasno.
V kemiji in fiziki atomska teorija pojasnjuje, kako se je naše razumevanje atoma skozi čas spreminjalo. Včasih so atomi veljali za najmanjše delce snovi. Zdaj pa je znano, da so atomi sestavljeni iz protonov, nevtronov in elektronov. Ti subatomski delci so sestavljeni iz kvarkov. Prvo idejo o atomu je podal grški filozof Demokrit. Veliko zamisli v sodobni teoriji je dal John Dalton, britanski kemik in fizik.
Teorija velja za trdne snovi, tekočine in pline, ne velja pa za plazmo ali nevtronske zvezde.
Zgodovina atomske teorije
Razvoj atomske teorije je potekal postopoma, z vrsto izkušenj in modelov:
- Antika: Demokrit je že v 5. st. pr. n. št. predlagal idejo, da je snov sestavljena iz nedeljivih delcev, ki jih je imenoval atomos.
- Daltonov model (začetek 19. st.): John Dalton je predlagal, da so atomi nedeljive enote kemijskih elementov s konstantnimi množinskimi razmerji v spojinah.
- Thomsonov model: odkritje elektronov (konec 19. st.) je vodilo k predstavi "pus in rozine" — nabiti elektrončki v pozitivno nabiti snovi.
- Rutherfordov model: zlata folija in prebojne izkušnje so pokazale, da ima atom majhno, gosto, pozitivno nabito jedro, okoli katerega krožijo elektroni.
- Bohrjev model: Niels Bohr je uvedel kvantizirane orbite za elektrone, kar je pojasnilo spektre atomov (posebej vodika).
- Kvantno-mehanski model: razvoj Schrödingerjeve valovne mehanike, Heisenbergove matrike in principa nedoločnosti je vodil do sodobnega pogleda, kjer so elektroni opisani z valovnimi funkcijami in verjetnostnimi gostotami (orbitali).
Zgradba in osnovni pojmi
Osnovni sestavni deli atoma:
- Jedro: sestavljeno iz protonov (pozitivni naboj) in nevtronov (ničelni naboj). Skupaj določajo večino mase atoma.
- Elektronski oblak: elektroni (negativni naboj) zavzamejo prostorsko razporeditev okoli jedra v energijskih nivojih in orbitalah; njihovo vedenje opisuje kvantna mehanika.
- Atomska številka (Z): število protonov določa element in njegove kemijske lastnosti.
- Masa in izotopi: različno število nevtronov vodi do izotopov istega elementa (različne atomske mase, pogosto različne stabilnosti).
- Ioni: če atom izgubi ali pridobi elektrone, nastane nabit delec — ion (kation ali anion), kar spreminja kemijsko vedenje.
Kvarkna in jedrska zgradba
Protoni in nevtroni niso osnovni — sestavljeni so iz kvarkov (up, down) in izmenjujočih se gluonov. Jedrske sile (močna jedrska sila) med kvarki in med nukleoni držijo jedro skupaj. Pri zelo visokih energijah ali v ekstremnih pogojih (na primer v jedrih zvezd ali v eksperimentih trkovnih pospeševalnikov) nastopijo pojavi, kot je kvark-gluonska plazma, kjer se običajna atomska zgradba poruši.
Eksperimentalni dokazi in metode
Ključni eksperimenti, ki so oblikovali atomsko teorijo:
- Katodne žarke: odkritje elektronov (J. J. Thomson).
- Zlata folija: Rutherfordovo preizkušanje, ki je razkrilo majhno gosto jedro.
- Spektroskopija: črte v spektrih elementov so podprle kvantizacijo energijskih nivojev (Bohr) in omogočile razvoj kvantne mehanike.
- Moderni poskusi: pospeševalniki, detektorji delcev in spektrometri mas omogočajo natančno preučevanje jedrske in subjedrske zgradbe.
Meje in izjeme atomske teorije
Atomska teorija odlično opisuje kemične lastnosti snovi in ravnanje posameznih atomov v pogojih sobotne energije. Vendar obstajajo omejitve:
- Plazma: v močno ioniziranih plazmah večina atomov izgubi elektrone; medsebojne interakcije in kolektivni pojavi zahtevajo drugi pristop.
- Nevtronske zvezde: v ekstremnih gostotah in pritiskih v jedrih nevtronskih zvezd atomska zgradba ne velja; snov je v drugačnem stanju (prevladajo nevtroni ali eksotični agregati).
- Visoke energije: pri energijah, kjer nastopajo procesi kvantne kromodinamike (QCD) ali kjer se sproščajo nove delce, klasični atomski modeli niso zadostni.
Pomen v kemiji in fiziki
Atomska teorija je temelj moderne kemije (razlaga vezi, reakcij, periodičnih lastnosti elementov) in velik del sodobne fizike (atomska, jedrska in delčna fizika). Poznavanje atomske strukture omogoča razvoj materialov, farmacije, nanotehnologije in energijskih rešitev.
Zaključek: Atomi niso več preproste nedeljive enote, kot je domneval Demokrit, ampak kompleksne strukture s plastmi organizacije — od elektronov in nukleonov do kvarkov in gluonov. Atomska teorija se je razvila prek eksperimentov in novih teorij ter ostaja osrednji del razumevanja snovi, hkrati pa ima jasne meje v ekstremnih pogojih.

Demokrit je bil grški filozof, 460 let pr. n. št.

Roger Joseph Boscovich. Hrvaški jezuit, ki je predstavil prototip atomske teorije

John Dalton (1766-1844), angleški kemik in fizik
Sir Joseph John Thomson (1856-1940), angleški fizik, je odkril elektron in njegov negativni naboj. Prejel je Nobelovo nagrado za fiziko
Demokritova atomska teorija
Demokrit je menil, da če nekaj vedno znova prerežeš na pol, se boš končno moral ustaviti. Rekel je, da tega zadnjega kosa snovi ni mogoče več zmanjšati. Demokrit je te majhne koščke snovi imenoval atomi, kar pomeni "nedeljivi". Menil je, da atomi trajajo večno, da se nikoli ne spremenijo in da jih ni mogoče uničiti. Demokrit je menil, da med atomi ni ničesar in da bi lahko vse, kar nas obdaja, razložili, če bi razumeli, kako delujejo atomi.
Nekateri drugi filozofi so se s tem strinjali, drugi pa ne. S poskusi niso mogli dokazati, ali je njegova teorija resnična ali ne.
Boscovicheva atomska teorija
Leta 1758 je Roger Joseph Boscovich opisal predhodnika atomske teorije.
Daltonova atomska teorija
Leta 1803 je angleški znanstvenik John Dalton, rojen v Cumberlandu, predelal Demokritovo teorijo, in sicer:
- Vsa snov je sestavljena iz atomov.
- Da so atomi nedeljivi in nevidni delci.
- Da so atomi istega elementa enake vrste in mase.
- Atomi, ki sestavljajo kemične spojine, so prisotni v določenih razmerjih.
- Kemijske spremembe so povezane z reorganizacijo atomov, ki sodelujejo v kemijski reakciji.
Dalton je atom opredelil kot osnovno enoto elementa, ki lahko sodeluje v kemijski kombinaciji.
Thomsonov atomski model
Leta 1850 je sir William Crookes izdelal "razelektritveno cev", to je stekleno cev z odstranjenim zrakom in kovinskimi elektrodami na koncih, priključeno na vir visoke napetosti. Ko v cevi ustvarimo vakuum, lahko opazimo svetlobni razelektritev, ki gre od katode (negativno nabite elektrode) do anode (pozitivno nabite elektrode). Crookes je emisijo poimenoval "katodni žarki".
Po poskusih s katodnimi žarki je sir Joseph John Thomson ugotovil, da so oddajani žarki posledica negativnih nabojev, ker jih privlači pozitivni pol. Thomson je vedel, da so atomi električno nevtralni, vendar je ugotovil, da mora imeti atom za to enako količino negativnih in pozitivnih nabojev. Negativne naboje je poimenoval elektroni (e-).
Na podlagi predpostavk o nevtralnem naboju atomov je Thomson predlagal prvi model atoma, ki je bil opisan kot pozitivno nabita krogla, v katero so bili vgrajeni elektroni (z negativnim nabojem). Znan je kot model slivovega pudinga.
Leta 1906 je Robert Millikan ugotovil, da imajo elektroni Coulombov (C) naboj -1,6 * 10−19, kar je omogočilo izračun njihove mase, ki je bila majhna in je znašala 9,109 * 10 −31kg.
Istočasno je Eugene Goldstein leta 1886 s poskusi s katodnimi cevmi ugotovil, da imajo pozitivni naboji maso 1,6726 * 10 −27kg in električni naboj +1,6 * 10 C−19. Lord Ernest Rutherford je te pozitivno nabite delce kasneje poimenoval protoni

Shematski prikaz Thomsonovega modela.
Rutherfordov atomski model
Leta 1910 je novozelandski fizik Ernest Rutherford predstavil idejo, da so pozitivni naboji atoma večinoma v njegovem središču, v jedru, elektroni (e-) pa okoli njega.
Rutherford je to dokazal, ko je z virom sevanja alfa (iz helija) zadel zelo tanke zlate plošče, obdane s senčnikom iz cinkovega sulfida, ki so ob udaru sevanja alfa proizvajale vidno svetlobo. Ta poskus se je imenoval Geiger-Marsdenov poskus ali poskus z zlato folijo.
Do te faze so bili jasni glavni elementi atoma, poleg tega pa je bilo odkrito, da se atomi posameznega elementa lahko pojavljajo v izotopih. Izotopi se razlikujejo po številu nevtronov v jedru. Čeprav je bil ta model dobro razumljiv, se je sodobna fizika še naprej razvijala in današnjih idej ni mogoče enostavno razumeti. Nekaj idej o današnji atomski fiziki si lahko ogledate na povezavah v spodnji tabeli.
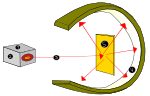
Atomski poskus lorda Ernesta Rutherforda
Sodobna fizika
Atomi niso elementarni delci, saj so sestavljeni iz subatomskih delcev, kot so protoni in nevtroni. Tudi protoni in nevtroni niso elementarni delci, ker so sestavljeni iz še manjših delcev, imenovanih kvarki, ki jih povezujejo drugi delci, imenovani gluoni (ker "lepijo" kvarke v atomu). Kvarki so elementarni delci, ker kvarkov ni mogoče več razčleniti.
Vprašanja in odgovori
V: Kaj je atomska teorija?
O: Atomska teorija pojasnjuje, kako se je naše razumevanje atoma skozi čas spreminjalo.
V: Kaj so nekoč mislili, da so atomi?
O: Včasih so atomi veljali za najmanjše delce snovi.
V: Iz česa so pravzaprav sestavljeni atomi?
O: Atomi so sestavljeni iz protonov, nevtronov in elektronov.
V: Iz česa so sestavljeni subatomski delci?
O: Subatomski delci so sestavljeni iz kvarkov.
V: Kdo je grški filozof, ki je prvi prišel na idejo o atomu?
O: Prvo zamisel o atomu je podal grški filozof Demokrit.
V: Kdo je britanski kemik in fizik, ki je prispeval številne ideje k sodobni teoriji?
O: John Dalton, britanski kemik in fizik, je prispeval veliko idej k sodobni teoriji.
V: Ali atomska teorija velja za plazmo ali nevtronske zvezde?
O: Teorija velja za trdne snovi, tekočine in pline, ne velja pa za plazmo ali nevtronske zvezde.
Iskati