Aromatske spojine (areni): benzen, aromatičnost, MAH, PAH in heteroareni
Razumevanje aromatskih spojin: benzen, aromatičnost, MAH, PAH in heteroareni — struktura, lastnosti, reakcije in pomen v kemiji ter okolju.
Aromatski ogljikovodik ali aren je spojina z ogljikovodikovim obročem. Med ogljikovimi atomi ima izmenično dvojne in enojne vezi, ki tvorijo obroče. Številne spojine imajo sladek vonj, odtod tudi izraz "aromatične". Obroč s šestimi ogljikovimi atomi v aromatskih spojinah je znan kot benzenov obroč po najpreprostejšem možnem ogljikovodikovem obroču, benzenu. Aromatski ogljikovodiki so lahko monociklični (MAH) ali policiklični (PAH).
Nekatere spojine, ki niso na osnovi benzena in se imenujejo heteroareni, ki upoštevajo Hücklovo pravilo, so tudi aromatske spojine. V teh spojinah je vsaj en ogljikov atom zamenjan s kisikom, dušikom ali žveplom.
Struktura in pojem aromatičnosti
Aromatičnost pomeni posebno stabilnost, ki izhaja iz delokaliziranega sistema π-elektronov okoli obroča. Pri benzenovem obroču so vse vezi enake dolžine zaradi delokalizacije elektronov; to lahko zamiselno predstavimo z dvema Kekuléjevima formulama, med katerima resonira resnična struktura. Aromatične spojine običajno izpolnjujejo Hücklovo pravilo (4n + 2 π elektronov, kjer je n celo število), so planarno poravnane in imajo zvezno konjugacijo π-orbital.
MAH (monociklični aromatski ogljikovodiki)
MAH so enociklični aromatični ogljikovodiki, katerih osnovni primer je benzen. Pogosti predstavniki in derivati vključujejo:
- toluol (metilbenzen),
- fenol (hidroksibenzen),
- anilin (aminobenzen).
MAH so pogosto izhodišča v organski sintezi in industriji (npr. proizvodnja barvil, zdravil, topil). Reaktivnost aromatičnega obroča je specifična — tipične reakcije so elektrofilne aromatske substitucije (nitracija, sulfonacija, halogenacija, Friedel–Crafts alkilacija/acyalacija), pri katerih obroč ohrani aromatičnost, substituent pa se zamenja ali doda.
PAH (policiklični aromatski ogljikovodiki)
PAH vsebujejo več kondenziranih aromatskih obročev (npr. naftalen, antracen, fenantren). Nastajajo pri nepopolnem zgorevanju organskih snovi, zato jih najdemo v dimu, izpušnih plinih, premogu in bitumu. Nekateri PAH so nevarni za zdravje — določeni so kancerogeni (npr. benzo[a]piren) in so predmet okoljske regulacije.
Heteroareni – aromatične spojine z heteroatomom
Pri heteroarenih je v obroč vključen vsaj en heteroatom (npr. dušik, kisik, žveplo). Primeri in lastnosti:
- pyridin (C5H5N) – aromatičen zaradi šestih π-elektronov; dušikov lone pair ni del π-sistema, zato je pyridin šibko bazičen;
- pyrrol (C4H5N) – lone pair dušika sodeluje v π-sistemu, zato je pyrrol manj bazičen ali nebasen v primerjavi s pyridinom;
- furán (kisikov heteroaren) in tiofen (žveplov heteroaren) – uporabljata lone pair za aromatičnost.
Pri heteroarenih je pomembno razumeti, kateri lone pari sodelujejo v π-sistemu in kako to vpliva na reaktivnost ter kislinsko-bazne lastnosti.
Kemijske in fizikalne lastnosti
- Reaktivnost: aromatski obroč je stabilen; najpogostejše reakcije so elektrofilne aromatske substitucije. Nekateri heteroareni so bolj ali manj reaktivni glede na naravo heteroatoma in substituentov.
- Fizikalne lastnosti: večina arenov je nepolarna ali šibko polarna, slabo topna v vodi, dobro topna v organskih topilih. Imajo relativno visoke tališča in vrelišča glede na nevrstne ogljikovodike podobne mase zaradi aromatske stabilnosti in ploščne strukture.
- Spektralna značilnost: aromatske spojine kažejo značilne absorpcije v UV/Vis območju in tipične NMR pomike protonov na aromatskem obroču, kar je uporabno pri identifikaciji.
Uporaba
Areni so pomembni v industriji in vsakdanjem življenju: kot topila (benzen, toluol), kot surovine za sintezo barvil, farmacevtikov, polimerov (npr. polistiren iz stirena), ter kot sestavine goriv in maziv. Heteroareni so ključni gradniki v mnogih zdravilih, bioloških molekulah in katalizatorjih.
Okoljski in zdravstveni vidiki
Medtem ko so nekateri MAH relativno manj problematični, so mnogi PAH in določeni aromatski monosubstituenti (npr. benzen) toksični ali kancerogeni. Vir PAH so industrijski izpusti, promet, kurilna goriva in onesnaženje tal. Zaradi strupenosti in obstojnosti so PAH predmet spremljanja v okolju in omejitev izpostavljenosti pri delu. Pri ravnanju z aromatskimi topili in surovinami je priporočljiva zaščita in upoštevanje varnostnih ukrepov (dobre prezračenosti, rokavic in očal).
Za splošno razumevanje aromatskih spojin je ključna kombinacija strukturnega pogleda (delokalizacija π-elektronov, planarno zgoščena zgradba) in praktičnih informacij o lastnostih, reaktivnosti, uporabi ter vplivih na zdravje in okolje.
Model benzenovega obroča
Benzen, C6 H6 , je najpreprostejši aromatski ogljikovodik in je bil prepoznan kot prvi aromatski ogljikovodik, naravo njegove vezi pa je prvi ugotovil Kekulé v 19. stoletju. Vsak ogljikov atom v šesterokotnem ciklu ima štiri elektrone, ki si jih lahko deli. En gre na vodikov atom, po en pa na dva sosednja ogljika. Tako ostane en, ki si ga deli z enim od dveh sosednjih ogljikovih atomov, zato je molekula benzena narisana z izmeničnimi enojnimi in dvojnimi vezmi okoli šestkotnika.
Struktura je ponazorjena tudi s krogom okoli notranjosti obroča, da bi prikazali šest elektronov, ki se gibljejo v delokaliziranih molekulskih orbitalah v velikosti samega obroča. To predstavlja tudi ekvivalentno naravo šestih vezi med ogljikom in ogljikom, od katerih je vsaka ekvivalentna ~1,5. Elektroni so prikazani kot plavajoči nad in pod obročem, elektromagnetna polja, ki jih ustvarjajo, pa ohranjajo obroč raven.
Splošne lastnosti:
- Prikaži aromatičnost.
- Razmerje med ogljikom in vodikom je visoko.
- Zaradi visokega razmerja med ogljikom in vodikom gorijo s sajasto rumenim plamenom.
- V njih potekajo substitucijske reakcije.
Simbol kroga za aromatičnost sta leta 1925 uvedla sir Robert Robinson in njegov učenec James Armit, od leta 1959 pa ga je populariziral učbenik za organsko kemijo Morrison & Boyd. O pravilni uporabi simbola se razpravlja; v nekaterih publikacijah se uporablja za opis vseh cikličnih pi sistemov, v drugih pa le za tiste pi sisteme, ki upoštevajo Hücklovo pravilo.
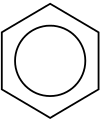
Benzen
Sinteza arena
Reakcija, pri kateri iz nenasičenega ali delno nenasičenega cikličnega prekurzorja nastane arenska spojina, se preprosto imenuje aromatizacija. Obstaja veliko laboratorijskih metod za organsko sintezo arenov iz nearenskih predhodnikov.
Pomen aromatskih spojin
Aromatske spojine imajo ključno vlogo v biokemiji vseh živih bitij. Štiri aromatske aminokisline histidin, fenilalanin, triptofan in tirozin so ena od 20 osnovnih gradnikov beljakovin. Poleg tega je vseh pet nukleotidov (adenin, timin, citozin, gvanin in uracil), ki sestavljajo zaporedje genetske kode v DNK in RNK, aromatičnih purinov ali pirimidinov. Poleg tega molekula hema vsebuje aromatski sistem z 22 π elektroni. Podoben aromatski sistem ima tudi klorofil.
Aromatske spojine so pomembne v industriji. Ključni aromatski ogljikovodiki, ki so pomembni za trgovino, so benzen, toluen, orto-ksilen in para-ksilen. Na svetu se jih vsako leto proizvede približno 35 milijonov ton. Pridobivajo se iz kompleksnih mešanic, pridobljenih z rafiniranjem nafte ali z destilacijo premogovega katrana. Uporabljajo se za proizvodnjo številnih pomembnih kemikalij in polimerov, vključno s stirenom, fenolom, anilinom, poliestrom in najlonom.
Vrste aromatskih spojin
Skoraj vse aromatske spojine so ogljikove spojine, vendar ni nujno, da so ogljikovodiki.
Heterociklični izdelki
V heterocikličnih aromatskih spojinah je eden ali več atomov v aromatskem obroču iz elementa, ki ni ogljik. Primeri so piridin, pirazin, imidazol, pirazol, oksazol in tiofen.
Policikli
Policiklični aromatski ogljikovodiki so molekule z dvema ali več preprostimi aromatskimi obroči, ki so spojeni z dvema sosednjima ogljikovima atomoma. Primeri so naftalen, antracen in fenantren.
Nadomeščeni aromatski ogljikovodiki
Številne kemične spojine so aromatski obroči, ki so jim priključene druge snovi. Primeri so trinitrotoluen (TNT), acetilsalicilna kislina (aspirin), paracetamol in nukleotidi v DNK.
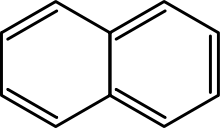
Nathlalene ima dva obroča.
Vprašanja in odgovori
V: Kaj je aromatični ogljikovodik?
O: Aromatski ogljikovodik je ogljikovodikova obročna spojina z izmeničnimi dvojnimi in enojnimi vezmi med ogljikovimi atomi, ki tvorijo obroče, in številne od teh spojin imajo sladek vonj.
V: Kako se imenuje obroč s šestimi ogljikovimi atomi v aromatskih spojinah?
O: Obroč s šestimi ogljikovimi atomi v aromatskih spojinah se imenuje benzenov obroč.
V: Kakšna je razlika med monocikličnimi (MAH) in policikličnimi (PAH) aromatskimi ogljikovodiki?
O: Monociklični aromatski ogljikovodiki (MAH) imajo v svoji strukturi en sam obroč ogljikovih atomov, policiklični aromatski ogljikovodiki (PAH) pa imajo v svoji strukturi dva ali več povezanih obročev ogljikovih atomov.
V: Zakaj se aromatski ogljikovodiki imenujejo "aromatski"?
O: Aromatski ogljikovodiki se imenujejo "aromatični", ker imajo mnogi med njimi sladek vonj.
V: Kaj so heteroareni in kako se razlikujejo od aromatskih spojin na osnovi benzena?
O: Heteroareni so spojine, ki niso na osnovi benzena in se ravnajo po Hücklovem pravilu ter so prav tako aromatske spojine. V teh spojinah je vsaj en ogljikov atom zamenjan s kisikom, dušikom ali žveplom.
V: Kateri je najenostavnejši ogljikovodikov obroč?
O: Najenostavnejši ogljikovodikov obroč je benzen.
V: Kateri sta dve vrsti aromatskih ogljikovodikov?
O: Dve vrsti aromatskih ogljikovodikov sta monociklični (MAH) in policiklični (PAH) aromatski ogljikovodiki.
Iskati