Benzen (C6H6): lastnosti, uporaba in nevarnosti
Benzen (C6H6): lastnosti, uporaba in nevarnosti — spoznajte strukturo, industrijsko rabo, rakotvornost ter praktične varnostne ukrepe in preprečevanje izpostavljenosti.
Benzen, znan tudi kot benzol, je organska kemična spojina s formulo 6CH6. Je brezbarvna in vnetljiva tekočina z značilnim rahlo sladkim vonjem. Molekule benzena so obroč iz šestih ogljikovih atomov, ki so vezani na en vodikov atom. Je aromatska spojina — to pomeni, da elektroni v obroču niso povezani kot stalne izmenične dvojne vezi, temveč so delokalizirani po obroču (rezonančno stabilizirani), kar daje benzenu posebno kemijsko stabilnost in značilno reaktivnost.
Fizikalne in kemijske lastnosti
Benzen pri običajnih pogojih nastopa kot tekočina. Nekatere splošne lastnosti:
- Fizični agregat: tekočina, brezbarna.
- Vonj: sladek, značilen za aromatske ogljikovodike.
- Topnost: slabo topen v vodi, dobro topen v organskih topilih.
- Kemična struktura: aromatski ciklični obroč s šestimi π-elektroni, ki sledijo Hückelovemu pravilu (4n+2, n=1), zato je molekula resonančno stabilizirana.
- Reaktivnost: benzen reagira pri elektrofilnih aromatskih substitucijah (npr. nitracija, sulfonacija, alkilacija), manj pa pri adicijskih reakcijah tipičnih za nenasičene vezi.
- Vnetljivost: parni mešanici s kisikom je lahko eksplozivna; hlapi so težji od zraka in se lahko zadržujejo pri tleh ali v zaprtih prostorih.
Uporaba
Benzen se v industriji uporablja kot surovina ali medprodukt za izdelavo številnih kemikalij in materialov. Primeri uporabe:
- kot sestavina in dodatek v bencinu, kar povečuje njegova oktanska in drugih lastnosti;
- kot osnovna surovina pri sintezi drugih spojin, na primer pri proizvodnji plastike in monomerov (npr. sintetični polimeri, kot je polistiren), sintetične gume in številnih industrijskih kemikalij;
- kot industrijsko topilo za maščobe, voske, smole in barvila;
- v proizvodnji barvil in sredstev za površinsko obdelavo;
- kot sestavni del surove nafte in zato prisoten v bencinu ter v rafinerijskih produktih;
- v farmacevtski industriji kot delne strukture ali medprodukt pri sintezi številnih zdravil — mnoge zdravila vsebujejo dele, ki so izpeljani iz benzena.
Nevarnosti in vpliv na zdravje
Benzen je rakotvoren, kar pomeni, da lahko povzroči raka. Med dolgoročno izpostavljenostjo benzenu so dokazane resne posledice za krvni sistem in kostni mozeg. Najpomembnejše zdravstvene točke:
- Kronične nevarnosti: dolgotrajna izpostavljenost lahko povzroči poškodbe kostnega mozga, zmanjšano tvorbo krvnih celic, aplastično anemijo in poveča tveganje za razvoj levkemije (zlasti mieloične oblike).
- Akutne posledice: visoke koncentracije hlapov lahko povzročijo omotico, glavobol, slabost, utrujenost, zmedenost, nezavest in v ekstremnih primerih smrt zaradi zaviranja dihalnega centra.
- Vnos v telo: inhalacija je najpomembnejša pot izpostavljenosti; pomembne so tudi absorpcija skozi kožo in požiranje.
- Posebne skupine tveganja: delavci v industrijah, ki obdelujejo benzen, in ljudje, ki živijo blizu virov kontaminacije (rafinerije, tovarne, neurejene odlagališča), so bolj izpostavljeni.
Okoljski vplivi
Benzen se v okolju hitro izhlapi v zrak, kjer se razgrajuje s fotooksidacijo, vendar lahko ob večjih izlitjih kontaminira tla in podtalnico. V vodi in tleh se delno razgradi biološko, vendar zaradi topnosti in adsorpcije v organske delce obstaja tveganje za dolgotrajnejšo kontaminacijo lokalnih ekosistemov. Zaradi hlapnosti in toksikologije je benzenu pripisana visoka stopnja okoljskega tveganja pri nesreči ali nepravilnem ravnanju.
Varnost pri delu in preprečevanje izpostavljenosti
Ker je benzen nevaren za zdravje, so običajno predpisani strogi ukrepi za njegovo uporabo in skladiščenje. Priporočila vključujejo:
- Ventilacija: dobro prezračevanje delovnih prostorov in uporaba lokalnih odsesovalnih sistemov;
- Osebna zaščitna oprema: respiratorji s primernimi filtromi, zaščitne rokavice, obleka in zaščita oči, kadar je mogoče stik;
- Skladiščenje: hraniti v tesno zaprtih, označenih posodah, na hladnem, suhem mestu, oddaljeno od virov vžiga in oxidantov; posode je treba ozemljiti in zaščititi pred statičnim nabojem;
- Preprečevanje izlitij: načrti za izredne razmere, absorbenti in postopki čiščenja z usposobljenim osebjem;
- Usposabljanje: izobraževanje delavcev o tveganjih, pravilen postopek ravnanja in postopki prve pomoči;
- Regulacija izpostavljenosti: izpostavljenost benzenu je strogo regulirana s strani industrijskih standardov in zdravstvenih predpisov — omejitve so običajno zelo nizke in se razlikujejo po državah; vedno upoštevajte lokalne predpise in priporočila.
Prva pomoč
- Če je oseba vdihnila hlape: prenesti na svež zrak, zagotoviti počitek in po potrebi medicinsko pomoč;
- Stik s kožo: takoj odstraniti kontaminirano obleko in kožo temeljito umiti z vodo in milom;
- Stik z očmi: spirati z veliko vode vsaj 15 minut in poiskati zdravniško pomoč;
- Požiranje: ne povzročati bruhanja; poiskati nujno medicinsko pomoč.
Alternativa in zmanjševanje tveganja
Ker je benzen škodljiv, industrija in raziskave iščejo manj nevarne alternative in postopke, ki zmanjšujejo njegovo uporabo. To vključuje uporabo drugih topil z nižjim tveganjem, izboljšane procese, recikliranje topil in tehnologije za zmanjšanje emisij pri proizvodnji.
Zaključek
Benzen je pomembna industrijska kemikalija z dobro znanimi fizikalno-kemijskimi lastnostmi in široko uporabo kot surovina ter topilo. Vendar ima resne zdravstvene in okoljske posledice — je rakotvoren in zahteva strogo regulacijo, varno ravnanje in nadzor izpostavljenosti. Pri delu z benzenom je ključna preventiva, ustrezna osebna zaščita in upoštevanje predpisov.
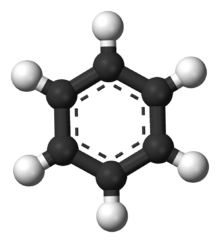
Model molekule benzena. Ogljikovi atomi so prikazani s črno barvo, vodik pa z belo.
_1964,_MiNr_440.jpg)
Leta 1964 je nemška pošta izdala znamko ob 100-letnici odkritja benzena.
Struktura
Benzen ima posebne lastnosti, ki se imenujejo aromatičnost. Vseh šest ogljikovih atomov v obroču je na isti ravni ploskvi. Za vse vezi v obroču s šestimi ogljikovimi spojinami morajo biti izmenične dvojne ogljikove vezi (konjugirani sistem):
Če bi imel benzen tri dvojne vezi, bi bile tri stranice njegovega obroča krajše od drugih treh stranic. Rentgenska difrakcija kaže, da je vseh šest vezi med ogljikom in ogljikom v benzenu enako dolgih - 140 pikometrov (pm). Dolžine vezi C-C so večje od dvojne vezi (135 pm), vendar krajše od enojne vezi (147 pm). Ta vmesna razdalja je skladna z delokalizacijo elektronov: elektroni za vez C-C so enakomerno porazdeljeni med vsakih šest ogljikovih atomov. Molekula je ravninska. Ena od predstav je, da struktura obstaja kot superpozicija tako imenovanih resonančnih struktur, ne pa kot vsaka od oblik posebej. (Z drugimi besedami, dvojne vezi v molekuli hitro prehajajo med pari ogljikovih atomov.) Delokalizacija elektronov je ena od razlag termodinamične stabilnosti benzena in sorodnih aromatskih spojin. Ta stabilnost verjetno prispeva k posebnim molekularnim in kemijskim lastnostim, ki jih imenujemo aromatičnost. Za prikaz delokalizirane narave vezi je benzen pogosto prikazan s krogom znotraj šestkotne razporeditve ogljikovih atomov.
Kot je v organski kemiji običajno, so ogljikovi atomi na zgornjem diagramu neoznačeni. Ker ima vsak ogljik 2p elektrona, vsak ogljik odda elektron v delokaliziran obroč nad in pod benzenovim obročem. Prav prekrivanje p-orbital nad in pod obročem je tisto, kar ustvarja pi oblake.
Leta 1986 so nekateri kemiki v članku, objavljenem v reviji Nature, oporekali delokaliziranemu pogledu na benzen. Pokazali so, da so elektroni v benzenu skoraj zagotovo lokalizirani na posameznih ogljikovih atomih. Pokazali so, da so aromatične lastnosti benzena posledica spinske sklopitve in ne delokalizacije elektronov. Drugi znanstveniki so leta 1987 v reviji Nature napisali članke, ki so podprli to stališče. Vendar kemiki počasi opuščajo stališče o delokaliziranih elektronih.
Derivati benzena se dovolj pogosto pojavljajo kot sestavni del organskih molekul, zato je v bloku Razno tehnično v Unicode zapisan simbol s kodo U+232C (⌬), ki ga predstavlja s tremi dvojnimi vezmi, in U+23E3 (⏣) za delokalizirano različico.
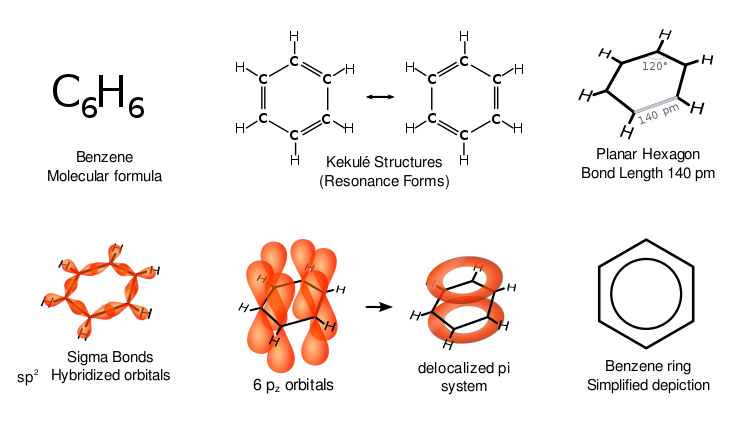
Različne predstavitve benzena
Vprašanja in odgovori
V: Kaj je benzen?
O: Benzen je organska kemična spojina.
V: Kakšna je kemijska formula benzena?
O: Kemijska formula benzena je C6H6.
V: Kakšen je videz in vonj benzena?
O: Benzen je brezbarvna in vnetljiva tekočina sladkega vonja.
V: Kakšna je struktura molekule benzena?
O: Molekula benzena je obroč iz šestih ogljikovih atomov, ki so vezani na en vodikov atom. To je aromatska spojina, kar pomeni, da se v obroču izmenjujejo dvojne vezi.
V: Ali je benzen rakotvoren?
O: Da, benzen je rakotvoren, kar pomeni, da lahko povzroči raka.
V: Katera je dejanska uporaba benzena?
O: Benzen se uporablja kot dodatek v bencinu, plastiki, sintetični gumi, barvilih in je industrijsko topilo, kar pomeni, da lahko raztopi številne druge kemične molekule. Tudi številna zdravila vsebujejo dele, ki so narejeni iz benzena.
V: Kje najdemo benzen?
O: Benzen je naravni del surove nafte, zato je prisoten v bencinu.
Iskati