Karbokation: definicija, struktura, stabilnost in reaktivnost
Karbokation: definicija, struktura, stabilnost in reaktivnost — poglobljen vodnik o sp2 hibridizaciji, trigonalni geometriji in mehanizmih stabilizacije.
Karbokation je ion s pozitivno nabitim ogljikovim atomom. Nabiti ogljikov atom v karbokationu ima le šest elektronov v zunanji valenčni lupini (to pomeni, da ima "sekstet" namesto običajnega okteta), torej v njej manjkajo dva elektrona, ki bi zapolnila elektronov do osmih. Ogljik s popolnim oktetom je termodinamsko najbolj stabilen (pravilo okteta), zato so karbokationi običajno reaktivni in se trudijo zapolniti oktet ter ponovno pridobiti nevtralen naboj.
Struktura in hibridizacija
Na prvi pogled bi karbokation razumeli kot ogljik s sp3 hibridizacijo z eno prazno sp3 orbitalo, kar bi dalo tetraedrsko geometrijo. V praksi pa je elektronika takih centrov bližje sp2 hibridizaciji: karbokation ima prazno p-orbitalo pravokotno na ploskev treh vezav in posledično približno trigonalno planarno geometrijo. Ta konfiguracija omogoča delokalizacijo pozitivnega naboja preko p-orbitale in pojasni opazno stabilizacijo pri določenih substituentih.
Vrste karbokationov
- Primarni, sekundarni, tercierni — glede na število ogljikov, vezanih na nabiti center. Tercierni karbokationi so običajno najbolj stabilni zaradi večje možnosti hyperkonjugacije in induktivne stabilizacije.
- Alilni in benzilni — karbokationi, kjer je nabiti center povezan z dvojno vezjo ali aromatskim sistemom; takšni centri se stabilizirajo z rezonanco.
- Vinilni in arilni — karbokationi, kjer je nabit karbon del dvojne vezi ali aromatičnega obroča; ti so praviloma zelo nestabilni, ker p-orbitala ne more enostavno delokalizirati naboja.
Faktorji stabilnosti
- Induktivni učinek: alkilne skupine s pozitivnim polarizacijskim učinkom preusmerijo gostoto proti nabitemu centru in ga stabilizirajo.
- Hyperkonjugacija: delokalizacija naboja preko σ-veze C–H ali C–C, ki je izrazito pri sekundarnih in terciernih karbokationih.
- Resonančna stabilizacija: če lahko pozitiven naboj delokaliziramo na sosedeče π-sisteme (npr. alilni, benzilni karbokation), je stabilnost pomembno povečana.
- Solventni in ionski učinki: polarna topila in soli (npr. superkislini) lahko stabilizirajo karbokation preko solvatacije in ionnih parov.
- Sterični učinki: močne sterilne motnje lahko v nekaterih primerih ovirajo stabilizacijo, a včasih dodatne alkilne skupine še vedno povečajo stabilnost zaradi hyperkonjugacije.
Nastanek karbokationov in mehanizmi
Karbokationi nastanejo v različnih organskih reakcijah, najpogostejši poti so:
- Heterolitična cepitev C–X (kjer X = halogen, OH po protonaciji): odcep več elektronov na enega partnerja pušča pozitiven naboj na ogljiku.
- Protonacija alkenov v kislih medijih, ki vodi do nastanka karbokationa (Markovnikovova adicija).
- Ionizacija estrov, etrov ali drugih funkcionalnih skupin v močno kislih pogojih.
- Redukcijsko-oksidacijski in fotokemični procesi, kjer se sproži heterolitična razpoka vezi.
Reaktivnost in lastnosti
- Nukleofilni napadi: karbokation je elektrofilen center; najbolj običajna reakcija je hitra vezava nukleofila, ki zapolni oktet in tvori novo vez.
- Eliminacije: karbokationi so med intermediati v E1 mehanizmih, kjer vodijo do nastanka alkenov.
- Rearanžmaji (hidridni ali alkilni preskoki): karbokationi pogosto prehajajo v bolj stabilne strukture z migracijo skupin (npr. hidridni premik iz sosednjega ogljika), kar vpliva na produkt reakcije.
- Hammondovo načelo pomaga napovedati, ali bo intermediat bolj “reaktiven” ali “stabilen” glede na energijo prehodnega stanja in naravo reakcije.
Opazovanje in uveljavljenost pojma
Karbokationi so pogosto kratkotrajni intermediatni tipi, a jih je možno opazovati ali stabilizirati v posebnih pogojih:
- Spektroskopske metode (NMR pri nizkih temperaturah, IR, UV–Vis) in lovilci nukleofilov omogočajo zaznavo ali zajetje karbokationov.
- Razvite so zelo stabilne, isolirane karbokationske soli (npr. s perfluoriranimi anioni), ki omogočajo neposredne študije strukture.
- V zgodovini sta bila izraza carbenium in carbonium uporabljena za različne tipe pozitivnih ogljikovih ionov; danes se za običajne trivalente pozitivne ogljikove centre uporablja izraz karbokation.
Pomembni koncepti za organske reakcije
- Pri načrtovanju reakcij je ocena relativne stabilnosti karbokationov ključna za napoved produktov (npr. ali bo prišlo do rearranžmaja).
- Razumevanje vpliva substituentov in topila omogoča nadzor nad selektivnostjo (kinetska vs. termodinamska kontrola).
- Karbokationi igrajo osrednjo vlogo v mnogih industrijskih procesih in laboratorijskih transformacijah, kot so alkilacije, izomerizacije in polimerizacije.
Sklep: Karbokationi so klasični elektrofili z značilno prazno p-orbitalo in približno trigonalno planarno geometrijo. Njihova stabilnost in reaktivnost sta odvisni od substitucije, resonance, hyperkonjugacije in okolijskih pogojev — razumevanje teh dejavnikov je temelj pri napovedovanju poteka številnih organskih reakcij.
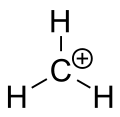
Karbenijev ion metana

terc-butil kation, ki kaže na planarno geometrijo
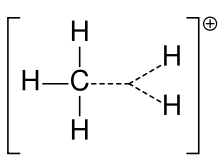
Karbonijev ion metana
Opredelitve
Karbokation so prej pogosto imenovali karbonijev ion, vendar se kemiki sprašujejo o natančnem pomenu. V današnji kemiji je karbokation vsak pozitivno nabit ogljikov atom. Predlagani sta dve posebni vrsti: karbenijevi ioni so trivalentni, karbonijevi ioni pa pentavalentni ali šestvalentni. V učbenikih na univerzitetni ravni se o karbokationih govori le, kot da gre za karbenijeve ione, ali pa se o karbokationih govori z bežnim sklicevanjem na starejšo besedno zvezo karbonijev ion ali karbenij in karbonijevi ioni. Eden od učbenikov še danes ostaja pri starejšem poimenovanju karbonijev ion za karbonijev ion in pridržuje besedno zvezo hipervalentni karbonijev ion za CH5+.
Zgodovina
Leta 1891 je G. Merling poročal, da je tropilidenu (cikloheptatrienu) dodal brom, nato pa produkt segrel in dobil kristalinično, v vodi topno snov, C
7H
7Br. Za to snov ni predlagal strukture, vendar sta Doering in Knox prepričljivo dokazala, da gre za tropilijev (cikloheptatrienov) bromid. Po Hücklovem pravilu naj bi bil ta ion aromatičen.
Leta 1902 sta Norris in Kehrman neodvisno odkrila, da brezbarvni trifenilmetanol v koncentrirani žveplovi kislini daje temno rumene raztopine. Trifenilmetil klorid je podobno tvoril oranžne komplekse z aluminijevim in kositrovim kloridom. Leta 1902 je Adolf von Baeyer ugotovil, da so nastale spojine podobne soli.
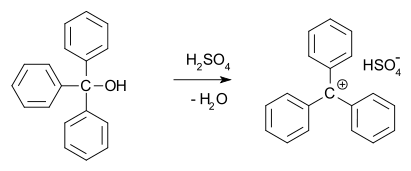
Razmerje med barvo in nastankom soli je poimenoval halohromija, katere najboljši primer je malahitno zeleno.
Karbokationi so reaktivni vmesni produkti v številnih organskih reakcijah. To idejo, ki jo je leta 1899 prvi predlagal Julius Stieglitz, je Hans Meerwein leta 1922 razvil v svoji študiji Wagner-Meerweinove preureditve. Ugotovljeno je bilo tudi, da so karbokationi vključeni v reakcijo NS1, reakcijo E1 in v reakcije preureditve, kot je Whitmorov premik 1,2. Kemijska stroka ni bila pripravljena sprejeti pojma karbokationa in Journal of the American Chemical Society je dolgo časa zavračal članke, ki so jih omenjali.
Prvi NMR-spekter stabilnega karbokationa v raztopini so leta 1958 objavili Doering in drugi. Šlo je za heptametilbenzenonijev ion, ki je nastal pri obdelavi heksametilbenzena z metilkloridom in aluminijevim kloridom. Stabilni 7-norbornadienilni kation so leta 1960 pripravili Story in sod. z reakcijo norbornadienil klorida s srebrovim tetrafluoroboratom v žveplovem dioksidu pri -80 °C. S spektrom NMR so ugotovili, da gre za neklasični mostiček (prvi opazovani stabilni neklasični ion).
Leta 1962 je Olah z jedrsko magnetno resonanco neposredno opazoval terc-butil karbokation kot stabilno vrsto pri raztapljanju terc-butil fluorida v čarobni kislini. O NMR norbornilovega kationa so prvi poročali Schleyer in sod., Saunders in sod. pa so pokazali, da je podvržen protonski skrambizaciji preko pregrade.
Lastnosti
V organski kemiji je karbokation pogosto tarča nukleofilnega napada nukleofilov, kot so hidroksilni (OH−) ioni ali halogenski ioni.
Glede na število ogljikovih atomov, vezanih na ionizirani ogljik, se karbokationi delijo na primarne, sekundarne ali terciarne. Primarne karbokatione imajo na ionizirani ogljik vezan en ali nič ogljikovih atomov, sekundarne karbokatione imajo na ionizirani ogljik vezana dva ogljikova atoma, terciarne karbokatione pa imajo na ionizirani ogljik vezane tri ogljikove atome.
Stabilnost karbokationa narašča s številom alkilnih skupin, vezanih na ogljik, ki nosi naboj. Terciarni karbokationi so stabilnejši (in se lažje tvorijo) kot sekundarni karbokationi; primarni karbokationi so zelo nestabilni, ker so ionizirani ogljiki višjega reda stabilizirani s hiperkonjugacijo, nesubstituirani (primarni) ogljiki pa ne. Zato reakcije, kot sta reakcija NS1 in eliminacijska reakcija E1, običajno ne potekajo, če bi se tvoril primarni karbokation. Izjema je, kadar je poleg ioniziranega ogljika dvojna vez med ogljikom in ogljikom. Takšni kationi, kot sta alil kation CH=CH-CH22+ in benzil kation6 CH-CH52+, so stabilnejši od večine drugih karbokationov. Molekule, ki lahko tvorijo alilne ali benzilne karbokatione, so še posebej reaktivne.
Karbokationi so podvrženi reakcijam preureditve iz manj stabilnih struktur v enako stabilne ali bolj stabilne strukture s konstantami hitrosti, ki presegajo 10/s9. To dejstvo otežuje sintetične poti do številnih spojin. Na primer, pri segrevanju 3-pentanola z vodno HCl se prvotno nastali 3-pentil karbokation preuredi v statistično mešanico 3-pentila in 2-pentila. Ti kationi reagirajo s kloridnim ionom, pri čemer nastane približno 1/3 3-kloropentana in 2/3 2-kloropentana.
Nekateri karbokationi, kot je norbornilov kation, imajo bolj ali manj simetrično vez s tremi središči. Tovrstni kationi se imenujejo neklasični ioni. Energijska razlika med "klasičnimi" karbokationi in "neklasičnimi" izomeri je pogosto zelo majhna, pri prehodu med "klasičnimi" in "neklasičnimi" strukturami pa je na splošno malo aktivacijske energije, če sploh obstaja. Neklasična oblika 2-butil karbokationa je v bistvu 2-buten s protonom neposredno nad središčem dvojne vezi ogljik-ogljik. Nekdaj so bile "neklasične" karbokatione predmet velikih polemik. Eden največjih prispevkov Georgea Olaha k kemiji je bila razrešitev te polemike.
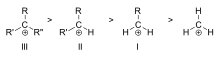
Vrstni red stabilnosti primerov terciarnih (III), sekundarnih (II) in primarnih (I) alkilnih karbokationov
Specifične karbokatione
Ciklopropilkarbinilne katione lahko preučujemo z NMR:
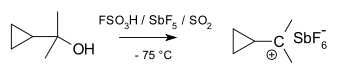
V spektru NMR dimetilnega derivata najdemo dva neenakovredna signala za dve metilni skupini, kar kaže, da molekularna konformacija tega kationa ni pravokotna (kot v A), ampak je razcepljena (kot v B), pri čemer sta prazna p-orbital in ciklopropilni obročni sistem v isti ravnini:
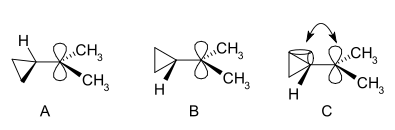
Z vidika teorije upognjenih vezi se ta prednost razloži s predpostavko ugodnega prekrivanja orbital med zapolnjenimi ciklopropanskimi upognjenimi vezmi in prazno p-orbitalo.
Vprašanja in odgovori
V: Kaj je karbokation?
O: Karbokation je ion s pozitivno nabitim ogljikovim atomom.
V: Kakšna je zunanja valenčna lupina karbokationa?
O: Zunanja valenčna lupina karbokationa ima le šest elektronov namesto stabilnih osmih valenčnih elektronov.
V: Zakaj so karbokationi pogosto reaktivni?
O: Karbokationi so pogosto reaktivni, ker skušajo zapolniti oktet valenčnih elektronov in ponovno pridobiti nevtralni naboj.
V: Kakšna je največja stabilnost ogljikovih atomov?
O: Največja stabilnost ogljikovih atomov je dosežena, če imajo osem valenčnih elektronov.
V: Kaj je sekstet v kemiji?
O: Sekstet je izraz, ki se uporablja za opis ogljikovega atoma v karbokationu, ki ima v zunanji valenčni lupini samo šest elektronov namesto stabilnih osmih valenčnih elektronov.
V: Kakšna je hibridizacija in molekulska geometrija karbokationa?
O: Čeprav bi logika kazala, da imajo karbokationi hibridizacijo sp3 s prazno orbitalo sp3, ki daje pozitiven naboj, je njihova reaktivnost bolj podobna hibridizaciji sp2 s trigonalno ravninsko molekulsko geometrijo.
V: Kaj je pravilo okteta?
O: Pravilo okteta je načelo v kemiji, ki pravi, da atomi običajno tvorijo kemijske vezi z drugimi atomi, ki omogočajo, da imata oba atoma stabilen niz osmih valenčnih elektronov.
Iskati