SN1 reakcija — definicija, mehanizem in primeri
SN1 reakcija: jasna, jedrnata razlaga definicije, mehanizma in praktičnih primerov z razlago karbokationa, pogojev in vpliva na reakcijsko hitrost.
Reakcija NS1 je substitucijska reakcija v organski kemiji. Izraz "SN" pomeni nukleofilno substitucijo, številka "1" pa označuje, da je v hitrostno določujočo fazo vključena samo ena molekula reagenta (unimolekularna). Reakcija poteka preko vmesnega produkta, karbokationa, in jo pogosto imenujejo tudi dissociativni mehanizem. Prvi predlog tega reakcijskega mehanizma sega v delo Christopherja Ingolda in sodelavcev v 40. letih 20. stoletja.
Mehanizem
Tipični dvofazni mehanizem SN1 vključuje:
- 1. korak (hitrostno določujoč): odvzem odstopne skupine (npr. halogenida, tosilata) iz substrata in tvorba karbokationa. Ta korak je unimolekularen in najpogosteje zahteva preseganje večje energetske ovire.
- 2. korak: nukleofil napade nastali karbokation in nastane produkt substitucije.
Ker je prvi korak hitrostno določujoč, je hitrost reakcije odvisna le od koncentracije substrata (npr. alkilnega halogenida), ne pa neposredno od koncentracije nukleofila.
Faktorski vplivi
- Struktura substrata: terciarni > sekundarni >> primarni. Terciarni alkilni halogenidi stabilizirajo karbokation z vplivom hiperkonjugacije in induktivnimi učinki.
- Odstopna skupina: dobra odstopna skupina (npr. I−, Br−, tosilat) olajša nastanek karbokationa in pospeši SN1.
- Topilo: polarna proticna topila (npr. voda, alkoholi) stabilizirajo karbokation in odstopno skupino z raztapljanjem, zato pospešijo SN1. Polarno aprotična topila pogosto podpirajo SN2 poti namesto SN1.
- Nukleofil: šibkejši nukleofili so običajno dovolj, saj napad ni v hitrostno določujočem koraku; močan nukleofil lahko spodbuja konkurenčno SN2 pot.
- Temperatura in baza: višja temperatura ter močne baze lahko povečajo delež E1 eliminacije, ki tekmuje s SN1.
Kinetika in stereokemija
Kinetika: hitrost reakcije SN1 opisuje enačba v = k [substrat] (prvi red). Eksperimentalna neodvisnost hitrosti od koncentracije nukleofila je značilni dokaz mehanizma SN1.
Stereokemija: ker karbokation velja za planarno (sp2) vrsto, napad nukleofila lahko poteka z obeh strani, kar pogosto vodi do racemizacije pri prezgodnjih stereoizomerih (npr. iz enantiomernega sekundarnega substrata). V praksi pa se lahko pojavijo delne ohranitev ali inverzija konfiguracije zaradi ionnih parov (intimni ali topološko vezani ion pari), kjer je dostop z ene strani omejen.
Zapleti in premiki
Vmesni karbokationi so nagnjeni k rearanžmajem (npr. hidridni prehod ali alkilni premik) v smer stabilnejšega karbokationa. Ti premiki lahko vodijo do nebolečnih produktov, ki se razlikujejo od neposredne substitucije pričakovanega mesta.
Primeri
- Solvoliza tert-butil klorida v vodi: (CH3)3C-Cl + H2O → (CH3)3C-OH + HCl. Ta reakcija poteka po SN1 mehanizmu z značilnim prvo-reden kinetičnim zakonom.
- Protonacija sekundarnih ali terciarnih alkoholov v močno kislih pogojih pogosto vodi do odstopa vode in tvorbe karbokationa, ki ga nato napade nukleofil (npr. solvoliza alkohola).
- Reakcije sekundarnih ali terciarnih alkilnih halogenidov v polarnih proticnih topilih z blagimi nukleofili običajno potekajo po SN1 poti; pri primarnih substratih je bolj verjetna alternativa SN2 (SN2).
Kako prepoznamo SN1 v praksi
- Merjenje hitrosti reakcije: hitrost neodvisna od koncentracije nukleofila (prvi red glede na substrat).
- Opazovanje racemizacije stereocentrov v produktu.
- Učinki topila: pospešitev v polarnih proticnih topilih.
- Prisotnost rearanžmov ali strukturnih produktov, ki kažejo na tvorbo karbokationa.
Če povzamemo: SN1 je unimolekularna nukleofilna substitucija, pri kateri je ključni korak disociacija substrata v karbokation in odstopno skupino. Najpogosteje jo opazimo pri terciarnih (in nekaterih sekundarnih) substratih v polarnih proticnih topilih z dobrimi odstopnimi skupinami; konkurenca s SN2 in E1 pa je odvisna od strukture, pogojev in narave nukleofila.
Mehanizem
Primer reakcije z reakcijskim mehanizmom NS1 je hidroliza terc-butilbromida z vodo, pri kateri nastane terc-butilalkohol:
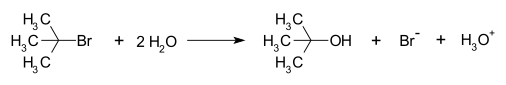
Reakcija NS1 poteka v treh korakih:
- Nastanek terc-butil karbokationa z ločevanjem izstopne skupine (bromidnega aniona) od ogljikovega atoma; ta korak je počasen in reverzibilen.
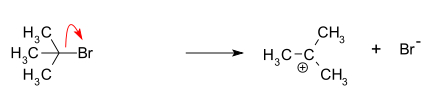
- nukleofilni napad: karbokation reagira z nukleofilom. Če je nukleofil nevtralna molekula (tj. topilo), je za dokončanje reakcije potreben še tretji korak. Če je topilo voda, je vmesni produkt oksonijev ion. Ta reakcijski korak je hiter.

- Deprotoniranje: Voda, ki deluje kot baza, odstrani proton na protoniranem nukleofilu in tvori alkohol in hidronijev ion. Ta reakcijski korak je hiter.
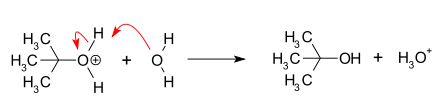
Ker je prvi korak ozko grlo ali "korak, ki določa hitrost", kemiki celoten reakcijski mehanizem razvrščajo kot NS1. Za ta korak je potrebna samo ena molekula.
Področje uporabe reakcije
Včasih lahko molekula reagira po mehanizmu NS1 ali NS2. Kadar je osrednji ogljikov atom obdan z obsežnimi skupinami, zmaga mehanizem NS1, saj takšne skupine sterilno ovirajo reakcijo NS2. Poleg tega obsežni substituenti na osrednjem ogljiku povečajo hitrost nastajanja karbokationov, ker se razbremenijo sterične napetosti. Nastali karbokation se stabilizira tudi z induktivno stabilizacijo in hiperkonjugacijo zaradi priključenih alkilnih skupin. Hammond-Lefflerjev postulat pravi, da tudi to poveča hitrost nastajanja karbokationov. Mehanizem NS1 torej prevladuje pri reakcijah na terciarnih alkilnih centrih in se v prisotnosti šibkih nukleofilov pojavlja tudi na sekundarnih alkilnih centrih.
Primer reakcije, ki poteka po postopku NS1, je sinteza 2,5-dikloro-2,5-dimetilheksana iz ustreznega diola s koncentrirano klorovodikovo kislino:
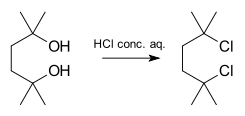
S povečevanjem substitucij alfa in beta glede na izstopajoče skupine se reakcija preusmeri iz NS2 v NS1.
Stereokemija
Vmesni karbokation, ki nastane v reakciji, ki omejuje hitrost, je sp 2hibridiziran ogljik s trigonalno ravninsko molekulsko geometrijo. To omogoča dve različni poti za nukleofilni napad, eno na obeh straneh planarne molekule. Če nobena od teh poti ni prednostno obravnavana, se ti dve poti uporabita enako, pri čemer nastane racemična mešanica enantiomerov, če reakcija poteka v stereocentru. To je ponazorjeno spodaj v NS1 reakciji S-3-kloro-3-metilheksana z jodidnim ionom, pri kateri nastane racemična zmes 3-jodo-3-metilheksana:
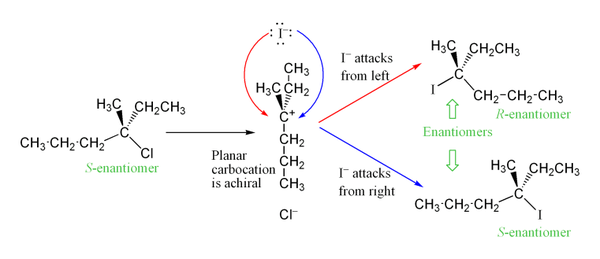
Vendar pa lahko opazimo presežek enega stereoizomera, saj lahko odhajajoča skupina za kratek čas ostane blizu vmesnega karbokationa in blokira nukleofilni napad. To se zelo razlikuje od mehanizma NS2, ki ne meša stereokemije produkta (stereospecifični mehanizem). Mehanizem NS2 vedno obrne stereokemijo molekule.
Neželeni učinki
Dve pogosti stranski reakciji sta reakciji eliminacije in preureditev karbokationov. Če reakcija poteka v toplih ali vročih pogojih (ki spodbujajo povečanje entropije), bo verjetno prevladovala eliminacija E1, ki vodi do nastanka alkena. Pri nižjih temperaturah sta reakciji NS1 in E1 konkurenčni reakciji. Zato je težko dati prednost eni pred drugo. Tudi če se reakcija izvaja na hladnem, lahko nastane nekaj alkena. Če poskušamo izvesti reakcijo NS1 z uporabo močno bazičnega nukleofila, kot je hidroksidni ali metoksidni ion, bo ponovno nastal alken, tokrat z eliminacijo E2. To še posebej velja, če reakcijo segrevamo. Če se lahko vmesni karbokation preuredi v stabilnejši karbokation, bo nastal produkt, ki izhaja iz stabilnejšega karbokationa, in ne produkt enostavne substitucije.
Učinki topila
Topila spremenijo hitrost reakcije. Ker reakcija NS1 vključuje nastanek nestabilnega karbokationskega intermediata v koraku, ki določa hitrost, bo vse, kar lahko k temu pripomore, pospešilo reakcijo. Običajna topila so polarna (za stabilizacijo ionskih intermediatov na splošno) in protična (zlasti za solvatacijo izstopajoče skupine). Tipična polarna protilna topila so voda in alkoholi, ki prav tako delujejo kot nukleofili.
Lestvica Y povezuje reakcijske hitrosti solvolize katerega koli topila (k) s hitrostjo reakcije standardnega topila (80 % v/v etanol/voda) (k0) s pomočjo
log ( k k ) 0= m Y {\displaystyle \log {\left({\frac {k}{k_{0}}}\right)}=mY\,}
pri čemer je m konstanta reaktanta (m = 1 za terc-butilklorid),
- Y je parameter topila in
- k0 je reakcijska hitrost pri uporabi topila 80 % etanola (merjeno po prostornini).
Na primer 100-odstotni etanol daje Y = -2,3, 50-odstotni etanol v vodi Y = +1,65 in 15-odstotna koncentracija Y = +3,2.
Vprašanja in odgovori
V: Kaj pomeni "SN" v besedi SN1 reakcija?
O: "SN" pomeni nukleofilno substitucijo.
V: Kaj pomeni "1" v reakciji SN1?
O: "1" pomeni dejstvo, da v koraku, ki določa hitrost, sodeluje samo ena molekula (enomolekularna).
V: Katera vrsta reakcije je SN1?
O: SN1 je substitucijska reakcija.
V: Kateri vmesni produkt je vključen v reakcijo SN1?
O: Reakcija SN1 vključuje vmesni produkt karbokation.
V: Pod katerimi pogoji potekajo običajne reakcije SN1?
O: Običajne reakcije SN1 potekajo s sekundarnimi ali terciarnimi alkil halidi v močno bazičnih pogojih ali s sekundarnimi ali terciarnimi alkoholi v močno kislih pogojih.
V: Katera alternativna reakcija poteka s primarnimi alkil halidi?
O: Pri primarnih alkil halidih pride do alternativne reakcije SN2.
V: Kdo je prvi predlagal reakcijski mehanizem SN1 in v katerem letu?
O: Christopher Ingold in drugi so prvi predlagali reakcijski mehanizem SN1 leta 1940.
Iskati
