Cheletropske reakcije – periciklične reakcije: definicija, mehanizem, primeri
Cheletropske reakcije: jasna definicija, mehanizmi, korak za korakom primeri in aplikacije — razumevanje tvorbe dveh vezi na enem atomu v pericikličnih procesih.
Cheletropske reakcije so vrsta pericikličnih reakcij, pri katerih en atom na enem od reagentov dobi dve novi vezi. Periciklična reakcija je reakcija, ki vključuje prehodno stanje s cikličnim nizom atomov in s tem povezanim cikličnim nizom interakcijskih orbital. V tem cikličnem polju pride do reorganizacije vezi σ in π.
Cheletropske reakcije so podrazred cikloadicij. Cheletropske reakcije se razlikujejo po tem, da se pri enem od reagentov obe novi vezi tvorita na isti atom. Nekaj primerov je prikazanih na desni strani slike 1. V prvem primeru je edini atom ogljikov atom v karbonilni skupini. Ta ogljikov atom se konča v ogljikovem monoksidu. Končni rezultat je vzpostavitev dveh novih vezi z enim atomom. Prva dva primera sta znana kot "cheletropna iztisnitev", ker se pri reakciji izloči majhna stabilna molekula. Pogonska sila teh reakcij je pogosto entropična korist od sproščanja plina (npr. CO ali N2).
Definicija in osnovni principi
Cheletropska reakcija je periciklična cikloadicija, pri kateri nastaneta dve novi vezi, vendar sta obe vezani na isti atom v enem od reaktantov. Prehodno stanje je ciklično in reakcija poteka koordinirano — to pomeni, da poteka brez vmesnih, daljših radikalnih ali ionskih stopinj, kadar gre za koncertedni potek. Najpogosteje gre za interakcijo med večnatomskim π-sistemom in monovalentnim centrom (npr. karben, atom žvepla ali ogljika z več vezmi).
Mehanizem in orbitalna simetrija
Ker so cheletropske reakcije periciklične, jih urejajo pravila o ohranitvi orbitalne simetrije (Woodward–Hoffmann). Pomembno je naslednje:
- Prehodno stanje vključuje zaprt krog interakcijskih orbital (σ in π), zato je možno le, če so faze in simetrija ujemajoče.
- Termalno ali fotokemično dovoljenje: glede na število vključenih elektronov in način pristopa (suprafacialno ali antarafacialno) lahko določena cheletropska reakcija poteka termalno ali pa zahteva fotonsko ekscitacijo.
- Stereospecificnost: ko reagira singlet karben ali drug reagenta s parno konfiguracijo orbital, je potek pogosto concerted in stereospecifičen — na primer stereokemija alkena se prenese v produkt (cis → cis, trans → trans pri ciklopropanizaciji).
Stereokemija in vpliv reaktivnega centra
Vrsta reaktivnega centra (npr. singlet ali triplet karben) močno vpliva na mehanizem in stereokemijo:
- Singlet karbeni (npr. :CH2, :CCl2) običajno reagirajo concertedno in cheletropno, kar daje stereospecifične produkte — ciklopropani z ohranjeno stereokemijo iz izhodiščnega alkena.
- Triplet karbeni pogosto reagirajo preko radikalnih, stopnjami posredovanih poti, kar lahko vodi do izgube stereospecifičnosti ali do radikalnih stranskih produktov.
- V primeru heteroatomov (S, N, O) ali delcev z neparnimi elektroni so možni kompleksnejši poteki z delokalizacijo nabojev in alternativnimi prehodnimi stanji.
Tipični primeri
- Ciklopropanizacija alkenov s karbeni: dodatek karbenov (npr. metilenski :CH2 ali dichlorokarben :CCl2) na dvojno vez je klasičen primer cheletropske reakcije — nastane ciklopropan, pri katerem sta obe novi vezi vezani na isti ogljikov atom karbena.
- Dodatek žvepla(IV) dioksida (SO2) na diene: reakcija 1,3-dienov z SO2 lahko poteka kot cheletropska adicija in tvori sulfolene ali sorodne produkte; ta proces se uporablja tudi v sintezi in kot reverzibilna pot (izločanje SO2).
- Cheletropne iztisnitve: obrat cheletropske adicije, kjer se izloči majhna molekula (npr. CO, N2, SO2), velja za pogost mehanizem, ki ga poganje entropična korist in stabilnost izločenega plina.
Pogoji reakcije in praktični pomen
Cheletropske reakcije se lahko sprožijo termično ali fotokemično glede na simetrijo vključenih orbital. V praksi so pomembne v organski sintezi zaradi naslednjih razlogov:
- Omogočajo hitro oblikovanje dveh vezi na enem centru (npr. pri ciklopropanizaciji), kar je uporabno pri pripravi obročnatih struktur.
- Cheletropne iztisnitve (izločanje majhnih molekul) se uporabljajo kot pogonski korak v zaporedjih reakcij za pridobivanje aromatskih ali zmanjšanih struktur.
- Razumevanje orbitalne simetrije omogoča nadzor nad stereokemijo produkta in izbiro ustreznih pogojev (termalno vs fotokemično).
Povezava do teorije in eksperimenta
Za pravilno načrtovanje in razlago cheletropskih reakcij so koristni računalniški izračuni (DFT), študije prehodnih stanj in eksperimenti s stereokemijo (npr. uporaba označenih substratov). V eksperimentalnem delu se poleg karbenov pogosto uporabljajo reagentni sistemi, ki generirajo reaktivne enote in omogočajo selektivno cheletropno adicijo ali iztisnitev.
Zaključek
Cheletropske reakcije so specifičen, a pomemben podrazred pericikličnih procesov, kjer en atom tvori hkrati dve vezi. Njihova concerted narava, odvisnost od orbitalne simetrije in praktična uporabnost v organski sintezi jih naredijo za koristen koncept tako v teoriji kot v laboratoriju. Posebej so uporabne pri ciklopropanizacijah, tvorbi heterocikličnih struktur in v postopkih, kjer se z izločitvijo majhne molekule doseže termodinamična prednost.

Slika 1. Periciklične reakcije
Teoretična analiza
Zaradi geometrije molekul, vključenih v cheletropske reakcije, potrjujejo številne napovedi teoretičnih kemikov. Cheletropske reakcije potrjujejo ohranitev simetrije molekulskih orbital.
V pericikličnem prehodnem stanju majhna molekula daruje obroču dva elektrona. Reakcijo lahko razložimo z dvema možnima geometrijama. Majhna molekula se lahko približuje linearno ali nelinearno. Pri linearnem pristopu so elektroni v orbitali male molekule usmerjeni neposredno v sistem π velike molekule. Pri nelinearnem približevanju se orbitalni del približuje pod rahlim kotom. Sposobnost sistema π, da se ob približevanju majhne molekule vrti, je ključnega pomena pri tvorbi novih vezi. Smer vrtenja se razlikuje glede na to, koliko π-elektronov je v sistemu. Spodaj je prikazan diagram dvoelektronskega fragmenta, ki se približuje štirielektronskemu π-sistemu z uporabo mejnih molekulskih orbital. Če se majhna molekula približuje linearno, je vrtenje disrotacijsko, če se približuje nelinearno, pa konrotacijsko. Disrotatorna in konrotatorna oblika pove, kako se vrtijo vezi v π-sistemu. Disrotacija pomeni nasprotno smer, konrotacija pa isto smer. To je prikazano tudi na spodnjem diagramu.
S Hucklovim pravilom lahko ugotovimo, ali je π-sistem aromatski ali antiaromatski. Če je aromatski, se pri linearnih pristopih uporablja disrotacijsko gibanje, pri nelinearnih pa konrotacijsko gibanje. Nasprotno velja za antiaromatski sistem. Pri linearnih pristopih bo uporabljeno konrotatorno gibanje, pri nelinearnih pa disrotatorno gibanje.
Cheletropske reakcije, ki vključujejo SO2
Termodinamika
Pri reakciji žveplovega dioksida z butadienom in izoprenom nastaneta dva različna produkta. Mehanizem reakcije določa, kaj nastane. Možna sta kinetični in termodinamični produkt. Termodinamičnega produkta nastane več kot kinetičnega. Kinetični produkt nastane pri Diels-Alderjevi reakciji, medtem ko pri cheletropski reakciji nastane termodinamsko stabilnejši produkt. Cheletropska pot se uporablja bolj, ker se pri njej ustvari stabilnejši adukt s petčlenskim obročem. Spodnja shema prikazuje razliko med obema produktoma. Pot na levi strani prikazuje termodinamični produkt, pot na desni strani pa kinetični produkt. Suarez in Sordo sta to pokazala leta 1995. To sta pokazala s poskusi in z izračuni po Gaussiju.
Kinetika
Primer tega so cheletropne reakcije 1,3-dienov z žveplovim dioksidom. Kemiki so natančno preučili kinetiko te reakcije. Leta 1976 sta Isaacs in Laila izmerila kinetične faktorje za dodajanje žveplovega dioksida derivatom butadiena. Hitrost dodajanja sta spremljala v benzenu pri 30 °C z začetnim dvajsetkratnim presežkom diena. Za merjenje izginotja SO2 sta uporabila spektrofotometer za preučevanje svetlobe pri valovni dolžini 320 nm. Reakcija je pokazala "kinetiko psevdo prvega reda". Kemiki so ugotovili, da elektronsko odtujene skupine na dienu zmanjšajo hitrost reakcije. Na hitrost reakcije so znatno vplivali tudi sterični učinki 2-substituentov, pri čemer so obsežnejše skupine povečale hitrost reakcije. (Z drugimi besedami, večja kot je bila skupina atomov, ki je visela z drugega ogljikovega atoma, hitreje je potekala reakcija.) Avtorja to pripisujeta težnji, da velike skupine spodbujajo cisoidno konformacijo diena, ki je bistvena za reakcijo (glej spodnjo tabelo). Poleg tega so za sedem dienov izmerili hitrosti pri štirih temperaturah. Na podlagi teh meritev so kemiki s pomočjo Arrheniusove enačbe izračunali entalpijo aktivacije (ΔH‡) in entropijo aktivacije (ΔS‡) za vsako reakcijo. To je bil eden prvih pomembnih poskusov preučevanja kenetike cheletropske reakcije.
| -butadien | 104 k /min−1 (30 °C) (± 1-2 %) absolutno | 104 k /min−1 (30 °C) (± 1-2 %) relativno | ΔH ‡/kcal mol−1 | ΔS ‡/cal mol−1 K −1 |
| 2-metil | 1.83 | 1.00 | 14.9 | -15 |
| 2-etil | 4.76 | 2.60 | 10.6 | -20 |
| 2-izopropil | 13.0 | 7.38 | 12.5 | -17 |
| 2-terc-butil | 38.2 | 20.8 | 10.0 | -19 |
| 2-neopentil | 17.2 | 9.4 | 11.6 | -18 |
| 2-cloro | 0.24 | 0.13 | NI RELEVANTNO | NI RELEVANTNO |
| 2-bromoetil | 0.72 | 0.39 | NI RELEVANTNO | NI RELEVANTNO |
| 2-p-tolil | 24.7 | 13.5 | 10.4 | -19 |
| 2-fenil | 17.3 | 9.45 | NI RELEVANTNO | NI RELEVANTNO |
| 2-(p-bromofenil) | 9.07 | 4.96 | NI RELEVANTNO | NI RELEVANTNO |
| 2,3-dimetil | 3.54 | 1.93 | 12.3 | -18 |
| cis-1-metil | 0.18 | 0.10 | NI RELEVANTNO | NI RELEVANTNO |
| trans-1-metil | 0.69 | 0.38 | NI RELEVANTNO | NI RELEVANTNO |
| 1,2-dimetilen-cikloheksan | 24.7 | 13.5 | 11.4 | -16 |
| 2-metil-1,1,1,4,4-d4 | 1.96 | NI RELEVANTNO | NI RELEVANTNO | NI RELEVANTNO |
Monnat, Vogel in Sordo so leta 2002 izmerili kinetiko dodajanja žveplovega dioksida 1,2-dimetilidencikloalkanom. Zapisali so, da lahko pri reakciji 1,2-dimetilidencikloheksana z žveplovim dioksidom nastaneta dva različna produkta, odvisno od reakcijskih pogojev. Pod kinetičnim nadzorom (≤ -60 °C) nastane ustrezni sultin s hetero-Diels-Alderjevo reakcijo, pod termodinamičnim nadzorom (≥ -40 °C) pa s cheletropsko reakcijo nastane ustrezni sulfen. Aktivacijska entalpija za hetero-Diels-Alderjevo reakcijo je za približno 2 kcal/mol manjša kot za ustrezno cheletropsko reakcijo. Sulfolen je približno 10 kcal/mol stabilnejši od izometričnega sultina v raztopini CHCl/SO. 222
Avtorjem je uspelo eksperimentalno določiti hitrostni zakon pri 261,2 K za reakcijo 1,2-dimetilidenecikloheksana z žveplovim dioksidom, pri kateri nastane ustrezni sulfen. Reakcija je potekala v prvem redu za 1,2-dimetilidencikloheksan, v drugem redu pa za žveplov dioksid (glej spodaj). To je potrdilo napoved teoretičnih kemikov, ki je temeljila na kvantnih izračunih ab initio na visoki ravni. Z uporabo računalniških metod so avtorji predlagali prehodno strukturo za cheletropsko reakcijo 1,2-dimetilidencikloheksana z žveplovim dioksidom (glej sliko desno). Reakcija je drugega reda v žveplovem dioksidu, ker se na prehodno stanje verjetno veže druga molekula žveplovega dioksida in ga pomaga stabilizirati. Podobni rezultati so bili ugotovljeni v študiji Suareza, Sorda in Sordoja iz leta 1995, v kateri so z ab initio izračuni preučili kinetični in termodinamični nadzor reakcije žveplovega dioksida z 1,3-dienom.
d [ ]3 d t = k [ 2]1 [ S O ] 2{\displaystyle2 {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}
Učinki topil
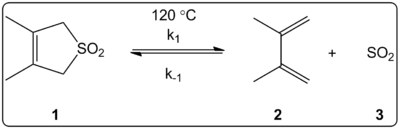
Vpliv topila na cheletropsko reakcijo 3,4-dimetil-2,5-dihidrotiofen-1,1-dioksida (na sliki desno) smo kinetično raziskali v 14 topilih. Ugotovljeno je bilo, da so konstante hitrosti reakcije naprej in nazaj ter konstante ravnotežja linearno povezane z lestvico polarnosti topila ET(30).
Reakcije so potekale pri 120 °C, preučevali pa smo jih z 1H-NMR spektroskopijo reakcijske zmesi. Ugotovljeno je bilo, da se hitrost k1 pri prehodu iz cikloheksana v metanol zmanjša za faktor 4,5. Ugotovljeno je bilo, da se povratna hitrost k-1 poveča za faktor 53, ko se iz cikloheksana preide na metanol, medtem ko se ravnotežna konstanta Keq zmanjša za faktor 140. Predpostavlja se, da se med procesom aktivacije spremeni polarnost, kar dokazujejo razmerja med ravnotežnimi in kinetičnimi podatki. Avtorji pravijo, da se zdi, da na reakcijo vpliva polarnost topila, kar je mogoče dokazati s spremembo dipolnih momentov pri prehodu iz reaktanta v prehodno stanje v produkt. Avtorji prav tako navajajo, da se zdi, da na cheletropno reakcijo ne vpliva niti kislost niti bazičnost topila.
Na podlagi rezultatov te študije avtorji pričakujejo naslednja vedenja:
1. Sprememba polarnosti topila bo na hitrost vplivala manj kot ravnotežje.
2. Za hitrostne konstante bo značilen nasprotni učinek polarnosti: k1 se bo rahlo zmanjšal s povečanjem ET(30), k-1 pa se bo pod enakimi pogoji povečal.
3. Učinek na k-1 bo večji kot na k. 1

Reakcija 1,2-dimetilidenecikloheksana s SO2 daje sultin s hetero-Diels-Alderjevo reakcijo pod kinetičnim nadzorom ali sulfolen s heletropsko reakcijo pod termodinamičnim nadzorom

Predlagano prehodno stanje za reakcijo 1,2-dimetilidenecikloheksana s SO2, pri kateri nastane sulfolen s heletropno reakcijo
Preučevanje heletropne reakcije v različnih topilih
Adicije karbena na alkene
Ena od sintetično najpomembnejših cheletropnih reakcij je dodajanje singletnega karbena alkenu, da nastane ciklopropan (glej sliko levo). Karben je nevtralna molekula, ki vsebuje dvovalentni ogljik s šestimi elektroni v valenčni lupini. Zaradi tega so karbeni zelo reaktivni elektrofili in nastajajo kot vmesni produkti reakcij. Singletni karben vsebuje prazno orbitalo p in približno 2hibridno orbitalo sp, ki ima dva elektrona. Singletni karbeni se stereospecifično dodajajo alkenom, pri čemer se stereokemija alkena ohrani v produktu ciklopropanu. Mehanizem za dodajanje karbena na alken je usklajena [2+1] cikloadicija (glej sliko). Karbene, pridobljene iz kloroforma ali bromoforma, lahko uporabimo za dodajanje CX2 alkenu, da dobimo dihalociklopropan, medtem ko Simmons-Smithov reagent dodaja CH2.
Interakcija zapolnjene karbenske orbitale s π sistemom alkena ustvari štirielektronski sistem in spodbuja nelinearni pristop. Prav tako je ugodno mešati prazno p orbitalo karbena z napolnjeno π orbitalo alkena. Do ugodnega mešanja pride z nelinearnim pristopom (glej sliko 2 desno). Čeprav je teorija jasno naklonjena nelinearnemu pristopu, pa ni očitnih eksperimentalnih posledic za linearni ali nelinearni pristop.

Dodajanje karbena alkenu za nastanek ciklopropana

Slika 2. A) Orbitale za singletne karbene B) Nelinearni pristop k a) sp2 orbitali karbena in b) p orbitali karbena
Vprašanja in odgovori
V: Kaj je cheletropična reakcija?
O: Cheletropna reakcija je vrsta periciklične reakcije, pri kateri en atom enega od reagentov dobi dve novi vezi.
V: Kaj je periciklična reakcija?
O: Periciklična reakcija je reakcija, ki vključuje prehodno stanje s cikličnim nizom atomov in s tem povezanim cikličnim nizom interakcijskih orbital, v katerem pride do reorganizacije vezi َ in ً.
V: Kako se razlikuje od drugih vrst reakcij?
O: Cheletropske reakcije so podrazred cikloadicij, od drugih vrst reakcij pa se razlikujejo po tem, da se na enem od reagentov obe novi vezi vzpostavita na isti atom.
V: Kateri so nekateri primeri?
O: Primeri vključujejo "cheletropne ekstrudence", na primer, ko en atom v karbonilni skupini konča v ogljikovem monoksidu.
V: Kaj poganja te reakcije?
O: Pogonska sila teh reakcij je pogosto entropična korist od sproščanja plina (npr. CO ali N2).
V: Ali je slika 1 povezana s cheletropskimi reakcijami? O: Da, slika 1 prikazuje primere cheletropskih reakcij.
Iskati
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)