Periodni sistem elementov: pregled, zgradba in kemijske lastnosti
Pregled periodnega sistema: zgradba, periode, skupine in kemijske lastnosti elementov. Od Mendelejeva do žlahtnih plinov — jasen vodnik za hitro razumevanje.
Periodni sistem kemijskih elementov je urejen seznam vseh znanih kemijskih elementov. V tabeli so elementi razporejeni po vrstnem redu atomskih števil, začenši z najmanjšim številom ena, vodik. Atomsko število elementa je enako številu protonov v jedru atoma in določa identiteto elementa. V periodnem sistemu so elementi razporejeni po periodah in skupinah. Vrstica v tabeli se imenuje perioda (številčena od 1 do 8). Prva perioda vsebuje le dva elementa: vodik in helij. Obdobji 2 in 3 imata po 8 elementov, daljše periode pa vsebujejo več elementov in vključujejo tudi prehodne elemente ter lantanoide in aktinoide. V vsaki periodi se elementi pojavljajo z naraščajočimi atomskimi števili.
Zgradba tabele in elektronska konfiguracija
Stolpec v tabeli se imenuje skupina. V standardnem periodnem sistemu je 18 skupin; vsaka ima svoje številčenje od 1 do 18. Elementi v isti skupini imajo sorodno razporeditev elektronov v zunanji (valenčni) lupini, zato imajo podobne kemijske lastnosti. Na primer, elementi z istim številom valenčnih elektronov pogosto tvorijo podobne spojine in reagirajo na podoben način. Skupina 18 so inertni plini ali žlahtni plini, ki zaradi popolnih zunanjih lupin reagirajo le redko.
Moderna razvrstitev temelji na elektronskih lupinah in nivojih ter deli tabelo na bloke (s, p, d, f), ki odražajo orbitale, ki se polnijo z elektroni. To razporejanje po blokih pomaga razumeti kemijsko obnašanje: npr. elementi s-bloka (skupini 1–2) so običajno zelo reaktivni kovinski elementi, medtem ko p-blok vsebuje širok spekter lastnosti od kovin do nekovin.
Glavne skupine elementov
- Skupina 1: alkalijske kovine — zelo reaktivne, mehke kovine (npr. cezij je zelo kovinski).
- Skupina 2: zemeljske alkalijske kovine — manj reaktivne od skupine 1, vendar še vedno tipično kovinske.
- Prehodni elementi (skupine 3–12): običajno kovine z več oksidacijskimi stanji, pomembne v industriji in kot katalizatorji.
- Skupina 17: halogeni — zelo reaktivne nekovine, tvorijo soli z alkalijskimi kovinami.
- Skupina 18: žlahtni plini — plini z zelo nizko reaktivnostjo zaradi polnih valenčnih lupin.
- Lantanoidi in aktinoidi: običajno so prikazani ločeno spodaj tabele; mnogi aktinoidi so radioaktivni in nekateri so sintetični.
Periodni zakon in zgodovina
Kemiki so periodni sistem uporabljali za prepoznavanje vzorcev in napovedovanje lastnosti neodkritih elementov. Zgodovinsko je pomemben prispevek dal ruski kemik Dmitrij IvanovičMendelejev (1834-1907), ki je v 19. stoletju uredil elemente po atomskih masah in napovedal lastnosti še neodkritih elementov; kasneje je postalo jasno, da je bolj temeljna vrednost za razvrščanje atomsko število (Moseley), kar je utrdilo sodobni periodni zakon. Leta 1990 je Mednarodna zveza za čisto in uporabno kemijo (IUPAC) sprejela enotno številčenje skupin z arabskimi številkami, ki je nadomestilo starejše sisteme, vključno z rimskimi številkami.
Periodični trendi in kemijske lastnosti
V periodnem sistemu se pojavljajo ponavljajoči se trendi, ki omogočajo napovedovanje lastnosti elementov:
- Atomski polmer: narašča navzdol v skupini (več elektronov in več lupin), zmanjšuje se z leve proti desni v periodi zaradi večjega pozitivnega naboja jedra.
- Ionizacijska energija: energija potrebna za odstranitev elektrona; običajno narašča levo→desno in zmanjšuje se navzdol.
- Elektronegativnost: sposobnost atoma, da privlači elektrone v vezi; narašča levo→desno in zmanjšuje navzdol (razen za žlahtne pline, kjer merjenje ni smiselno).
- Metaličnost: elementi pri dnu in levo tabele so najbolj kovinski, elementi zgoraj desno so nekovine. Metaloidi so v prehodni regiji med kovinami in nekovinami.
Posebnosti in sodobni vidiki
Več elementov, predvsem pri visokih atomskih številih, je sintetičnih in radioaktivnih; njihova stabilnost običajno upada z naraščajočim številom protonov. Periodni sistem se še naprej razvija z odkritji novih, prehodnih ali supertežkih elementov ter z izboljšanim razumevanjem jedrskih in kvantno-mehanskih učinkov. Element 101 je v čast Mendelejevu poimenovan mendelejev.
Uporaba periodnega sistema
Periodni sistem je ključno orodje v kemiji, fiziki, materialnih znanostih, biologiji in inženirstvu. Omogoča hitro primerjavo lastnosti elementov, ocenjevanje njihove reaktivnosti in izbiro primernih elementov za zlitine, katalizatorje, energetiko, medicino in druge tehnologije.
Z razumevanjem razporeditve elektronov, skupin in period ter periodičnih trendov lahko raziskovalci in študenti hitro predvidevajo vedenje elementov in načrtujejo kemijske reakcije ter nove materiale.
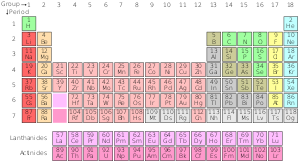
Standardna različica periodnega sistema
Standardni periodni sistem
| Skupina→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 12 | 13 | 14 | 15 | 16 | 17 | ||||
| 1 | 2 | |||||||||||||||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||||||||||||
| 3 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||
| 4 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | ||
| 5 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | ||
| 6 | 55 | 56 | * Lantanidi | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | ||
| 7 | 87 Fr | 88 | ** Aktinidi | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | ||
| 8 | 119 Uue | 120 Ubn | *** Superaktinidi | |||||||||||||||||
| * Lantanidna serija | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | |||||
| ** Serija aktinidov | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 | |||||
| *** Serija superaktinidov | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129Ube | 130Utn | 131Utu | 132Utb | 133Utt | 134Utq | 135Utp | |||||
| *** Serija superaktinidov | 136Uth | 137Uts | 138Uto | 139Ute | 140Uqn | 141Uqu | 142Uqb | 143Uqt | 144Uqq | 145Uqp | 146Uqh | 147Uqs | 148Uqo | 149Uqe | 150Upn | |||||
| *** Serija superaktinidov | 151Upu | 152Upb | 153Upt | 154Upq | 155Upp | 156Uph | 157Ups | 158Upo | 159Upe | 160Uhn | 161Uhu | 162Uhb | 163Uht | 164Uhq | 165 konjskih moči | |||||
| *** Serija superaktinidov | 166Uhh | 167Uhs | 168Uho | 169Uhe | 170Usn | 171Usu | 172Usb | 173Ust | 174Usq | 175Usp | 176Ush | 177Uss | 178Uso | 179Uporaba | 180Uon | |||||
| *** Serija superaktinidov | 181Uv | 182Uob | 183Uot | 184Uoq | 185Uop | 186Uoh | 187Uos | 188Uoo | 189Uoe | 190Uen | 191Ueu | 192Ueb | 193Uet | 194Ueq | 195Uep | |||||
| *** Serija superaktinidov | 196Ueh | 197Ues | 198Ueo | 199Uee | 200Bnn | 201Bnu | 202Bnb | 203Bnt | 204Bnq | 205Bnp | 206Bnh | 207Bns | 208Bno | 209Bne | 210Bun | |||||
| *** Serija superaktinidov | 211Buu | 212Bub | 213Ale | 214Buq | 215Bup | 216Buh | 217Bus | 218Buo | 219Bue | 220 milijard EUR | 221Bbu | 222Bbb | 223Bbt | 224Bbq | 225Bbp | |||||
Kemijske serije periodnega sistema
- Alkalne kovine
- Alkalne zemlje
- Lantanidi
- Aktinidi
- Superaktinidi
- Prehodne kovine
- Slabe kovine
- Nekovine
- Halogeni
Stanje pri standardni temperaturi in tlaku. Barva številke (atomskega števila) nad simbolom elementa kaže stanje elementa pri normalnih pogojih.
- v modri barvi so plini.
- v zeleni barvi so tekočine.
- tiste v črni barvi so trdne
- Tisti s polnimi robovi imajo stabilne izotope (prvobitni elementi).
- Tisti s črtkanimi mejami imajo samo radioaktivne izotope, ki se pojavljajo v naravi.
- Elementi s črtkano obrobo se ne pojavljajo v naravi (sintetični elementi).
- tiste brez meja so preveč radioaktivne, da bi jih še odkrili.
Druge metode za prikaz kemijskih elementov
Zgoraj prikazana različica periodnega sistema je najpogosteje uporabljena. Druge razširjene različice so prikazane spodaj:
· 
Theodor Benfey je elemente razporedil v spiralo okoli vodika. Atomska masa določa položaj elementa.
· 
Dmitrij Ivanovič Mendelejev je uporabil cvetlično razporeditev; aktinidi in lantanoidi so prikazani kot zanke poleg glavne skupine.
· 
Timothy Stove je elemente razvrstil po kvantnem številu.
· ![]()
Betterman je elemente razvrstil po njihovih izoelektričnih lastnostih, ki jih je mogoče pretvoriti v polinomsko obliko.
· 
Trikotna različica, Zmaczynski in Bayley
· 
Razporejeno v piramido.
Manj uporabljene različice
- Standardna tabela vsebuje osnovne podatke. Prikazana je zgoraj
- Navpična tabela za boljšo berljivost v spletnih brskalnikih
- Velika tabela vsebuje osnovne podatke in polna imena elementov.
- V veliki tabeli so na voljo osnovni podatki ter polna imena elementov in atomske mase.
- Konfiguracije elektronov
- Kovine in nekovine
- Seznam elementov: vsebuje ime, simbol, atomsko število, atomsko maso, skupino in periodo; razvrščanje po katerem koli od teh elementov.
- Seznam elementov po simbolu
- Seznam elementov po vrelišču
- Seznam elementov po temperaturi tališča
- Seznam elementov po gostoti
Sorodne strani
- Skupina periodnega sistema
- Obdobje periodnega sistema
- Razširjeni periodni sistem
Vprašanja in odgovori
V: Kaj je periodni sistem elementov?
O: Periodni sistem je tabela, v kateri so vsi znani kemijski elementi razvrščeni po atomskih številkah, začenši z vodikom na prvem mestu. Elementi s podobnimi lastnostmi so pogosto postavljeni drug ob drugega.
V: Koliko period in skupin je v standardnem periodnem sistemu?
O: V standardnem periodnem sistemu je 8 period in 18 skupin.
V: Kaj imajo elementi v periodi skupnega?
O: Elementi v periodi imajo zaporedna atomska števila.
V: Kaj imajo skupnega elementi v skupini?
O: Elementi v skupini imajo podobno razporejene elektrone glede na število valenčnih elektronov, kar jim daje podobne kemijske lastnosti.
V: Kdo je izumil periodni sistem?
O: Periodni sistem je izumil ruski kemik Dmitrij Ivanovič Mendelejev (1834-1907).
V: Katere so tri glavne skupine v periodnem sistemu?
O: Tri glavne skupine v periodnem sistemu so kovine, metaloidi in nekovine.
V: Kako lahko s pomočjo periodnega sistema opazujemo vzorce in odnose med elementi?
O: Vzorce in odnose med elementi lahko opazujemo tako, da pogledamo, kje se pojavljajo v periodnem sistemu; na primer, elementi spodaj levo so običajno bolj kovinski kot tisti zgoraj desno.
Iskati