Alkini (acetileni): trojna vez, lastnosti in reakcije
Alkini (acetileni): vse o trojni vezi, fizikalnih in kemijskih lastnostih ter ključnih reakcijah (adicije, redukcije, periciklične) — jasen vodnik za študij in laboratorijsko rabo.
Alkin je molekula s trojno vezjo med dvema ogljikovima atomoma. Imajo splošno formulo CnH2n-2. Imenujemo jih tudi acetileni. Najmanjši alkin je acetilen (IUPAC: etin) — torej ga ne smemo zamenjevati z etilenom (alken). Alkini so hidrofobni: to pomeni, da se dobro raztapljajo v organskih topilih, v vodi pa ne.
Alkini so bolj reaktivni kot običajni ogljikovodiki. V številnih reakcijah so na primer bolj reaktivni od alkenov. Če je alkin na koncu molekule, je enostavno odstraniti proton z močno bazo. Alkin lahko nato uporabimo v adicijskih reakcijah. Dodamo ga lahko na primer ketonu. Alkini se tudi zlahka reducirajo na dvojne vezi. Iz njih lahko naredimo trans- in cisdvojne vezi. Alkini se pogosto uporabljajo tudi v pericikličnih reakcijah.
Struktura in vez
V trojni vezi sta med ogljikoma ena σ- in dve π-vezi. Ogljikova atoma v trojni vezi sta sp-hybridizirana, zato je geometrija linearna (kot med C–C–C približno 180°). Trojna vez je krajša in močnejša kot dvojna ali enojna vez (tipična dolžina C≡C okoli 1,20 Å), kar vpliva na mehanske in elektronske lastnosti povezav.
Fizikalne lastnosti
- Faze in topnost: alkini so večinoma plini ali tekočine z nizko tališče/kuhno točko; raztapljajo se v organskih topilih, v vodi pa slabo.
- Polarnost: trojna vez nima velikega dipolnega momenta, zato so ogljikovodiki z alkini hidrofobni.
- Stabilnost: terminalni alkini (z vodikom na končnem ogljiku) so kisli glede na druge C–H vezi in lahko tvorijo acetilidne anione.
Kislost in tvorba acetilidnih anionov
Terminalni alkini so (za ogljikovodike) sorazmerno kisli: tipičen pKa je okoli 25. Zato jih je mogoče deprotonirati z močnimi bazami, kot so NaNH2, n-BuLi ali LDA, in tako pridobiti acetilidne anione (R–C≡C–). Ti anioni so močni nukleofili in se pogosto uporabljajo za tvorbo novih C–C vezi (npr. SN2 alkilacije z alkilhalidi).
Glavne vrste reakcij
- Hidrogenacija
- Polna hidrogenacija (H2/Pd) pretvori alkin v alkane.
- Selektivna hidrogenacija s Lindlarjevim katalizatorjem vodi do cis-alkenov (Z).
- Doseg trans-alkenov z redukcijo v raztopini amonijaka in natrijem (tako imenovana “dissolving metal” redukcija, Na/NH3).
- Adicija halogenov (Br2, Cl2) — vodi preko dihaloalkenov do tetrahalogeniranih alkanov pri nadaljnji adiciji.
- Hidracija — z Hg(II)-katalizo (Kucherovova reakcija) vodi do enola, ki tautomerizira v keton (Markovnikovova adicija). Za terminalne alkine je pogosto končni produkt keton, medtem ko hidroboracija-oksidacija (Sia2BH, nato H2O2/NaOH) daje anti-Markovnikov izomer, po tautomerizaciji pa aldehid.
- Adicija karbanionov in alkilacija — acetilidni anioni reagirajo z primarnimi alkilhalidi (SN2) in tvorijo nove C–C vezi.
- Oksidativno cepitev — močni oksidanti (npr. KMnO4, ozon) cepijo trojne vezi in tvorijo karboksilne kisline; če je na terminalnem ogljiku H, nastane CO2.
- Periciklične reakcije in cikloadicije — alkini sodelujejo v cikloadicijah (npr. Diels–Alder tipi z ustreznimi partnerji), pa tudi v modernih "click" reakcijah (Cu-catalyzed azide–alkyne cycloaddition, CuAAC), ki tvorijo triazole.
Uporabe
- Industrijsko: acetilen se uporablja za varjenje in rezanje (razlivanje s kisikom), kot tudi kot začetni material za sintezo drugih spojin.
- Organometalna kemija in sinteza: alkini so uporabni gradniki za izdelavo kompleksnih molekul v farmaciji, materialih in polimerih.
- Click kemija: terminalni alkini so ključni v CuAAC reakcijah za povezovanje molekul v biokemiji in materialih.
Varnost
Acetilen (C2H2) je zelo vnetljiv in lahko eksplodira pod tlakom, zato se v industriji pogosto shranjuje raztopljen v acetonu v jeklenkah. Pri delu z močnimi bazami, reducenti in halogenirajočimi sredstvi je potrebna primerna zaščita in nadzor pogojev (temperatura, suhost topila, inertna atmosfera).
Alkini so zato vsestranski in pomembni v organski sintezi zaradi svoje reaktivnosti, linearne geometrije in sposobnosti tvorbe novih vezi, vendar zahtevajo previdno ravnanje zaradi vnetljivosti in uporabe močnih reagentov.
Struktura
Alkini imajo med dvema ogljikovima atomoma kot 180 stopinj. Zaradi tega ne želijo biti v cikličnih spojinah. Nekaj primerov alkina je prikazanih spodaj.
| · v · t · e Funkcionalne skupine |
|
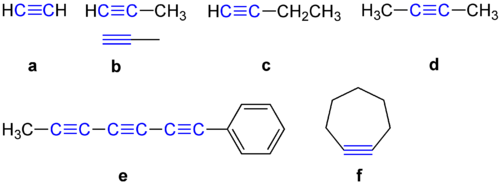
Primeri alkina
Vprašanja in odgovori
V: Kaj je alkin?
O: Alkin je molekula, ki ima trojno vez med dvema ogljikovima atomoma.
V: Kakšna je splošna formula alkina?
O: Splošna formula alkina je CnH2n-2.
V: Kateri je najmanjši alkin?
O: Najmanjši alkin je acetilen, imenovan tudi etin.
V: Ali so alkini hidrofobni ali hidrofilni?
O: Alkini so hidrofobni, kar pomeni, da se dobro raztapljajo v organskih topilih, ne pa tudi v vodi.
V: V čem se vsak zaporedni člen alkina razlikuje med seboj?
O: Vsak zaporedni član alkina se razlikuje po svoji molekularni obliki z "-CH2".
V: Ali so alkini bolj reaktivni kot običajni ogljikovodiki?
O: Da, alkini so v mnogih reakcijah bolj reaktivni od običajnih ogljikovodikov, kot so alkeni.
V: Kaj lahko naredimo z alkini na koncu molekule?
O: Če je alkin na koncu molekule, ga lahko zlahka odstranimo s protoniranjem z močno bazo in ga nato uporabimo v adicijskih reakcijah, na primer kot dodatek ketonu.
Iskati