Ogljikov dioksid (CO2): definicija, lastnosti in vpliv na podnebje
Odkrijte, kaj je ogljikov dioksid (CO2), njegove lastnosti, vloga kot toplogredni plin in vpliv na podnebje ter rešitve za ublažitev podnebnih sprememb.
Ogljikov dioksid (CO2) je kemijska spojina. Pri sobni temperaturi je plin. Sestavljen je iz enega atoma ogljika in dveh atomov kisika. Je brez barve in vonja; pri običajnih pogojih je manj gost od tekočin in topen v vodi v majhnih količinah. Ljudje in živali pri dihanju sproščajo ogljikov dioksid. Vsakič, ko nekaj organskega gori (ali nastane ogenj), nastane tudi ogljikov dioksid. Rastline uporabljajo ogljikov dioksid za izdelavo hrane. Ta proces se imenuje fotosinteza. Lastnosti ogljikovega dioksida je preučeval škotski znanstvenik Joseph Black v sredini 18. stoletja; opisal je plin, ki ga je poimenoval »fiksni zrak« in pokazal, da je drugačen od običajnega zraka.
Lastnosti in kemija
CO2 je linearna molekula s formulacijo CO2. Pri standardnih pogojih je plin, dobro mešljiv z zrakom. Absorbira infrardečo (toplotno) sevanje, kar je osnova njegove vloge kot toplogredni plin. V vodnih raztopinah tvori šibko ogljikovo kislino, kar vpliva na kislost oceanov (oceanografijo) in biokemične procese v morju.
Viri in ponori
- Naravni viri: dihanje živih organizmov, razkroj organske snovi, vulkanska dejavnost, izmenjava CO2 med oceanom in ozračjem.
- Človeški (antropogeni) viri: izgorevanje fosilnih goriv (premog, nafta, plin), industrijski procesi (npr. proizvodnja cementa), krčenje gozdov in spremembe rabe zemljišč.
- Ponori (mehanizmi odstranjevanja CO2): fotosinteza v kopnih in morskih rastlinah, absorpcija v oceanih ter dolgoročni procesi kemičnega vremenskega raztapljanja in usedanja v kamnine.
Vpliv na podnebje
Ogljikov dioksid je pomemben toplogredni plin. Toplogredni plini zadržujejo toplotno energijo, kar vpliva na podnebje in vreme na našem planetu Zemlja. Ko se koncentracija CO2 v ozračju poveča, se poveča tudi zmožnost atmosfere, da ujame toploto – to imenujemo podnebne spremembe. Povečanje koncentracij toplogrednih plinov prispeva k globalnega segrevanja, torej k dvigovanju povprečne temperature zemeljskega površja.
Posledice višjih koncentracij CO2 vključujejo:
- povišanje globalnih temperatur in pogostejše ter hujše vročinske valove;
- spremembe v padavinskih vzorcih, kar vodi do povečane suše na nekaterih območjih in močnejših poplav na drugih;
- dvig morske gladine zaradi taljenja ledenikov in termičnega širjenja vode;
- oceanokislost, ki škoduje koralam, školjkam in drugim organizmom z apnčastimi skeleti;
- motnje v ekosistemih, kmetijstvu, zdravju ljudi in gospodarstvu.
Koncentracije in življenjska doba v ozračju
V zadnjih stoletjih so se atmosferske koncentracije CO2 močno povečale zaradi industrijskih aktivnosti. Predindustrijska vrednost je bila približno 280 delov na milijon (ppm), v zadnjih letih pa je koncentracija presegla 400 ppm (v zadnjih desetletjih okoli ~410–420 ppm). CO2 v ozračju ostaja dolgo – del ogljika se lahko nahaja v atmosferi desetletja do stoletja ali dlje, zato so zmanjšanja emisij potrebna takoj, da bi omejili dolgoročne učinke.
Kaj lahko storimo
Za zmanjšanje vpliva ogljikovega dioksida in drugih toplogrednih plinov so potrebni ukrepi na več ravneh:
- Prehod na obnovljive vire energije: veter, sonce, hidroenergija in druge nizkoogljične rešitve;
- Večja energijska učinkovitost: pri ogrevanju, hlajenju, industriji in transportu;
- Ohranjanje in obnova gozdov: zadrževanje ogljika v biomasi in tleh;
- Tehnologije za zajem in shranjevanje ogljika (CCS): industrijski postopki za lovljenje CO2 in shranjevanje v podzemnih rezervoarjih;
- Spremembe v rabi zemlje in kmetijskih praksah: agroekološki pristopi, povečanje organske snovi v tleh;
- Osebni prispevki: zmanjšanje porabe energije, prehod na javni prevoz ali kolesarjenje, manjša poraba mesa in podaljšanje življenjske dobe izdelkov.
Razumevanje lastnosti in vplivov ogljikovega dioksida pomaga pri sprejemanju ukrepov za ublažitev podnebnih sprememb ter pri prilagajanju na že prisotne spremembe v podnebju. Kombinacija znanosti, politike in posameznih dejanj je ključna za zmanjšanje emisij in zaščito prihodnjih generacij.
Strukturna formula ogljikovega dioksida. C je ogljik, O pa kisik. Dvojne črte predstavljajo dvojno kemijsko vez med atomoma.
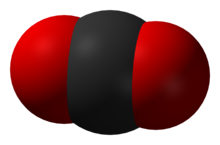
Slika, ki preprosto prikazuje, kako lahko atomi zapolnijo prostor. Črna barva je ogljik, rdeča pa kisik.
Biološka vloga
Ogljikov dioksid je končni produkt organizmov, ki pridobivajo energijo z razgradnjo sladkorjev, maščob in aminokislin s kisikom v okviru presnove. Ta proces je znan kot celično dihanje. To vključuje vse rastline, živali, številne glive in nekatere bakterije. Pri višjih živalih ogljikov dioksid v krvi potuje od telesnih tkiv do pljuč, kjer se izdihne. Rastline sprejemajo ogljikov dioksid iz ozračja in ga uporabljajo pri fotosintezi.
Suhi led
Suhi led ali trdni ogljikov dioksid je trdno stanje plina CO2 pod -109,3 °F (-78,5 °C). Suhi led se ne pojavlja v naravi na Zemlji, ampak ga je izdelal človek. Je brezbarven. Ljudje uporabljajo suhi led za ohlajanje stvari in pripravo gaziranih pijač, za uničevanje sviščev in zamrzovanje bradavic. Hlapi suhega ledu povzročijo zadušitev in sčasoma smrt. Pri uporabi suhega ledu sta priporočljiva previdnost in strokovna pomoč.
Pri običajnem tlaku se ne stopi iz trdne snovi v tekočino, temveč se neposredno spremeni iz trdne snovi v plin. To se imenuje sublimacija. Iz trdne snovi se neposredno spremeni v plin pri vseh temperaturah, ki so višje od izjemno nizkih temperatur. Suhi led sublimira pri običajni temperaturi zraka. Suhi led, ki je izpostavljen običajnemu zraku, oddaja ogljikov dioksid, ki nima barve. Ogljikov dioksid se lahko utekočini pri tlaku nad 5,1 atmosfere.
Plinski ogljikov dioksid iz suhega ledu je tako hladen, da ob mešanju z zrakom ohladi vodno paro v zraku, da nastane megla, ki je videti kot gost bel dim. Pogosto se uporablja v gledališču za ustvarjanje videza megle ali dima.

Suhi led, ko ga damo v vodo
Izolacija in proizvodnja
Kemiki lahko ogljikov dioksid pridobijo iz ohlajenega zraka. Temu pravijo destilacija zraka. Ta metoda je neučinkovita, saj je treba za pridobivanje majhne količine CO2 ohladiti veliko količino zraka. Kemiki lahko za ločevanje ogljikovega dioksida uporabijo tudi več različnih kemijskih reakcij. Ogljikov dioksid nastaja pri reakcijah med večino kislin in večino kovinskih karbonatov. Na primer pri reakciji med klorovodikovo kislino in kalcijevim karbonatom (apnenec ali kreda) nastane ogljikov dioksid:
2 H C l + C a C O 3 ⟶ C a C l 2 + H 2 C O 3 {\displaystyle \mathrm {2\ HCl+CaCO_{3}\longrightarrow CaCl_{2}+H_{2}CO_{3}} }
Ogljikova kislina (H2CO3) nato razpade na vodo in CO2. Takšne reakcije povzročajo penjenje ali mehurjenje ali oboje. V industriji se takšne reakcije večkrat uporabljajo za nevtralizacijo tokov odpadnih kislin.
Kemikalijo, ki se pogosto uporablja, je mogoče izdelati s segrevanjem apnenca na približno 850 °C. Pri tej reakciji nastane tudi CO2:
C a C O 3 ⟶ C a O + C O 2 {\displaystyle \mathrm {CaCO_{3}\longrightarrow CaO+CO_{2}} }
Ogljikov dioksid nastaja tudi pri zgorevanju vseh goriv, ki vsebujejo ogljik, kot so metan (zemeljski plin), naftni destilati (bencin, dizel, kerozin, propan), premog ali les. V večini primerov se sprošča tudi voda. Primer kemijske reakcije med metanom in kisikom je:
C H 4 + 2 O 2 ⟶ C O 2 + 2 H 2 O {\displaystyle \mathrm {CH_{4}+2\ O_{2}\longrightarrow CO_{2}+2\ H_{2}O} }
Ogljikov dioksid nastaja v jeklarnah. Železo se iz oksidov reducira s koksom v plavžu, pri čemer nastajata surovo železo in ogljikov dioksid:
F e 2 O 3 + 3 C O ⟶ 2 F e + 3 C O 2 {\displaystyle \mathrm {Fe_{2}O_{3}+3\ CO\longrightarrow 2\ Fe+3\ CO_{2}} }
Kvasnice presnavljajo sladkor in proizvajajo ogljikov dioksid in etanol, znan tudi kot alkohol, pri proizvodnji vin, piva in drugih žganih pijač, pa tudi pri proizvodnji bioetanola:
C 6 H 12 O 6 ⟶ 2 C O 2 + 2 C 2 H 5 O H {\displaystyle \mathrm {C_{6}H_{12}O_{6}\longrightarrow 2\ CO_{2}+2\ C_{2}H_{5}OH} }
Vsi aerobni organizmi proizvajajo CO
2 pri oksidaciji ogljikovih hidratov, maščobnih kislin in beljakovin v mitohondrijih celic. Veliko število reakcij, ki pri tem sodelujejo, je izjemno zapletenih in jih ni mogoče enostavno opisati. (Vključujejo celično dihanje, anaerobno dihanje in fotosintezo). Fotoavtotrofi (npr. rastline, cianobakterije) uporabljajo še eno reakcijo: Rastline absorbirajo CO
2 iz zraka in skupaj z vodo reagirajo v ogljikove hidrate:
n C O 2 + n H 2 O ⟶ ( C H 2 O ) n + n O 2 {\displaystyle \mathrm {nCO_{2}+nH_{2}O\longrightarrow (CH_{2}O)n+nO_{2}} }
Ogljikov dioksid je topen v vodi, v kateri spontano prehaja med CO2 in H
2CO
3 (ogljikova kislina). Relativne koncentracije CO
2, H
2CO
3 in deprotoniranih oblik HCO-
3 (bikarbonat) in CO2-
3 (karbonat) so odvisne od kislosti (pH). V nevtralni ali rahlo alkalni vodi (pH > 6,5) prevladuje bikarbonatna oblika (> 50 %), ki postane prevladujoča (> 95 %) pri pH morske vode, v zelo alkalni vodi (pH > 10,4) pa prevladuje (> 50 %) karbonatna oblika. Bikarbonatna in karbonatna oblika sta zelo topni. Tako z zrakom uravnotežena oceanska voda (blago alkalna s tipičnim pH = 8,2-8,5) vsebuje približno 120 mg bikarbonata na liter.
Industrijska proizvodnja
Industrijski ogljikov dioksid nastaja predvsem v šestih procesih:
- Z zajemanjem naravnih izvirov ogljikovega dioksida, ki nastaja pri delovanju zakisane vode na apnenec ali dolomit.
- Kot stranski proizvod obratov za proizvodnjo vodika, kjer se metan pretvori v CO2;
- Pri izgorevanju fosilnih goriv ali lesa;
- Kot stranski produkt fermentacije sladkorja pri varjenju piva, viskija in drugih alkoholnih pijač;
- Pri termični razgradnji apnenca se CaCO
3 pri proizvodnji apna (kalcijevega oksida, CaO);
Kemijska reakcija
Ogljikov dioksid lahko nastane s preprosto kemijsko reakcijo:
C + O 2 ⟶ C O 2 {\displaystyle \mathrm {C+O_{2}\longrightarrow CO_{2}} }
Vprašanja in odgovori
V: Kaj je ogljikov dioksid?
O: Ogljikov dioksid je kisla kemijska spojina, ki je sestavljena iz enega atoma ogljika in dveh atomov kisika ter je pri sobni temperaturi plin.
V: Kako se ogljikov dioksid sprošča v ozračje?
O: Ljudje in živali sproščajo ogljikov dioksid, ko izdihnejo, in vsakič, ko nekaj organskega gori ali nastane ogenj.
V: Kaj je fotosinteza?
O: Fotosinteza je proces, pri katerem rastline uporabljajo ogljikov dioksid za pridobivanje hrane.
V: Kdo je preučeval lastnosti ogljikovega dioksida?
O: Škotski znanstvenik Joseph Black je v petdesetih letih 17. stoletja preučeval lastnosti ogljikovega dioksida.
V: Kaj je toplogredni plin?
O: Toplogredni plin je plin, ki zadržuje toplotno energijo ter spreminja podnebje in vreme na planetu.
V: Kako ogljikov dioksid prispeva k podnebnim spremembam?
O: Ogljikov dioksid je toplogredni plin, ki prispeva k podnebnim spremembam, saj zadržuje toplotno energijo in povzroča globalno segrevanje, ki je dvig temperature zemeljskega površja.
V: Kako se je uravnavala koncentracija ogljikovega dioksida v Zemljinem ozračju?
O: Koncentracijo ogljikovega dioksida v Zemljinem ozračju že od konca prekambrija uravnavajo fotosintetični organizmi in geološki pojavi, predvsem vulkani.
Iskati






